12.下列物质中,质量最大的是(NA表示阿伏加德罗常数)( )
| A. | 10 g H2 | B. | 2molCl2 | C. | 1.5NACO2 | D. | 22.4LO2(标准状况) |
10.短周期元素X、Y、Z、W、R的化合价与原子序数的关系如图所示.下列说法不正确的是( )


| A. | X、Y都存在同素异形现象 | |
| B. | 工业上常用W的氧化物为原料制取单质W | |
| C. | Z和Y形成的化合物中只存在离子键 | |
| D. | 常温下单质W不能溶于R的最高价氧化物对应水化物的浓溶液 |
8.表是25℃时5种银盐的溶度积常数(Ksp):
下列说法中不正确的是( )
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积(Ksp) | 1.4×10-10 | 1.4×10-5 | 1.4×10-50 | 1.4×10-13 | 1.4×10-16 |
| A. | 在AgCl、Ag2SO4、AgBr、AgI饱和溶液中分别滴加Na2S溶液,均会生成相同的沉淀 | |
| B. | 25℃时,5种银盐饱和溶液中c(Ag+)最大的是Ag2SO4饱和溶液 | |
| C. | 25℃时,在等物质的量浓度的NaCl溶液和CaCl2溶液中加入足量的AgCl固体,形成饱和溶液,两溶液中AgCl溶度积相同,但c(Ag+)不同 | |
| D. | AgBr沉淀可转化为AgI沉淀,而AgI沉淀不可能转化为AgBr沉淀 |
6.某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如下:(所加试剂均过量,气体全部逸出)下列说法正确的是( )
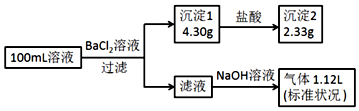

| A. | 原溶液一定存在CO32-和SO42-,一定不存在Fe3+ | |
| B. | 原溶液一定存在Cl-和Na+ | |
| C. | 原溶液中c(Cl-)≥0.2mol•L-1 | |
| D. | 若原溶液中c(NH4+)=0.05mol•L-1 |
5.(已知反应 Fe(s)+CO2(g)?FeO(s)+CO(g),△H=aKJ•mol-1,平衡常数为K.测得在不同温度下,K值如下:
(1)若500℃时进行反应①,CO2的起始浓度为2mol•L-1,CO的平衡浓度为1mol/L.
(2)该反应为吸热(选填“吸热”或“放热”)反应.
(3)700℃时反应达到平衡,要使该平衡向右移动,其他条件不变时,可以采取的措施有BC(填序号).
A.缩小反应器体积 B.CO2 C.升高温度到900℃D.使用合适的催化剂 E.增加Fe的量
(4)如图图象符合该反应的是A(填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T
2).

| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.4 |
(2)该反应为吸热(选填“吸热”或“放热”)反应.
(3)700℃时反应达到平衡,要使该平衡向右移动,其他条件不变时,可以采取的措施有BC(填序号).
A.缩小反应器体积 B.CO2 C.升高温度到900℃D.使用合适的催化剂 E.增加Fe的量
(4)如图图象符合该反应的是A(填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T
2).

4. 常温下,一些金属离子(用Mn+表示)形成M(OH)n沉淀与溶液pH平衡关系曲线如图.已知:c(Mn+)≤1×10-5 mol•L-1时可认为金属离子沉淀完全;pM=-lgc(Mn+),pKsp=-lgKsp.下列叙述正确的是( )
常温下,一些金属离子(用Mn+表示)形成M(OH)n沉淀与溶液pH平衡关系曲线如图.已知:c(Mn+)≤1×10-5 mol•L-1时可认为金属离子沉淀完全;pM=-lgc(Mn+),pKsp=-lgKsp.下列叙述正确的是( )
0 163825 163833 163839 163843 163849 163851 163855 163861 163863 163869 163875 163879 163881 163885 163891 163893 163899 163903 163905 163909 163911 163915 163917 163919 163920 163921 163923 163924 163925 163927 163929 163933 163935 163939 163941 163945 163951 163953 163959 163963 163965 163969 163975 163981 163983 163989 163993 163995 164001 164005 164011 164019 203614
 常温下,一些金属离子(用Mn+表示)形成M(OH)n沉淀与溶液pH平衡关系曲线如图.已知:c(Mn+)≤1×10-5 mol•L-1时可认为金属离子沉淀完全;pM=-lgc(Mn+),pKsp=-lgKsp.下列叙述正确的是( )
常温下,一些金属离子(用Mn+表示)形成M(OH)n沉淀与溶液pH平衡关系曲线如图.已知:c(Mn+)≤1×10-5 mol•L-1时可认为金属离子沉淀完全;pM=-lgc(Mn+),pKsp=-lgKsp.下列叙述正确的是( )| A. | Mn+开始沉淀的pH与起始溶液c(Mn+)无关 | |
| B. | 不同的金属沉淀完全时的pH相同 | |
| C. | 图中Y点与X点pKsp不相同 | |
| D. | Y点:pM=pKsp+npH-14n |

 Cr2O72-、Cr3+对环境具有极强的污染性,含有Cr2O72-、Cr3+的工业废水常采用NaOH沉淀方法除去.
Cr2O72-、Cr3+对环境具有极强的污染性,含有Cr2O72-、Cr3+的工业废水常采用NaOH沉淀方法除去.
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: