18. (1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
(1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
已知:CO燃烧热△H2=-283kj/mol
N2(g)+O2(g)=2NO(g)△H3
几种化学键的键能数据如表一:
表一:
上述△H3=+183kJ•moL-1,△H1=-749kJ•moL-1.
(2)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划.在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行下述反应I,测得不同时间的NH3和O2的浓度如表:
表二:
则下列有关叙述中正确的是AD
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4υ正(NH3)=6υ逆(H2O)时,说明反应已达平衡
C.当容器内$\frac{n(NO)}{n(N{H}_{3})}$=1时,说明反应已达平衡
D.前10分钟内的平均速率υ(NO)=0.088mol•L-1•min-1
(3)氨催化氧化时会发生下述两个竞争反应I、II.催化剂常具有较强的选择性,即专一性.已知:反应I:4NH3(g)+5O2(g)$?_{高温}^{Pt/Ru}$ 4NO(g)+6H2O(g)
反应II:4NH3(g)+3O2(g)$?_{高温}^{Cu/TiO_{2}}$ 2N2(g)+6H2O(g)
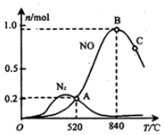
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1mol NH3和2mol O2,测得有关物质的量关系如图:
①该催化剂在高温时选择反应I(填“I”或“II”).
②520℃时,4NH3+3O2?2N2+6H2O的平衡常数K=$\frac{0.{2}^{4}×0.{9}^{6}}{0.{4}^{4}×1.4{5}^{5}}$(不要求得出计算结果,只需列出数字计算式).
③由图象可判断,反应I正反应△H<0(填“>”、“<”或“=”)
④C点比B点所产生的NO的物质的量少的主要原因升高温度平衡逆向移动.
(4)羟胺(NH2OH)的电子式 ,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
 (1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
(1)科学家寻找高效催化剂,通过如下反应实现大气污染物转化:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
已知:CO燃烧热△H2=-283kj/mol
N2(g)+O2(g)=2NO(g)△H3
几种化学键的键能数据如表一:
表一:
| 化学键 | N≡N | O=O | NO中氮氧键 |
| 键能(kJ/mol) | 945 | 498 | 630 |
(2)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划.在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行下述反应I,测得不同时间的NH3和O2的浓度如表:
表二:
| 时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
| c(NH3)/mol•L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.0072 | 0.0072 |
| c(O2)/mol•L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4υ正(NH3)=6υ逆(H2O)时,说明反应已达平衡
C.当容器内$\frac{n(NO)}{n(N{H}_{3})}$=1时,说明反应已达平衡
D.前10分钟内的平均速率υ(NO)=0.088mol•L-1•min-1
(3)氨催化氧化时会发生下述两个竞争反应I、II.催化剂常具有较强的选择性,即专一性.已知:反应I:4NH3(g)+5O2(g)$?_{高温}^{Pt/Ru}$ 4NO(g)+6H2O(g)
反应II:4NH3(g)+3O2(g)$?_{高温}^{Cu/TiO_{2}}$ 2N2(g)+6H2O(g)
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1mol NH3和2mol O2,测得有关物质的量关系如图:
①该催化剂在高温时选择反应I(填“I”或“II”).
②520℃时,4NH3+3O2?2N2+6H2O的平衡常数K=$\frac{0.{2}^{4}×0.{9}^{6}}{0.{4}^{4}×1.4{5}^{5}}$(不要求得出计算结果,只需列出数字计算式).
③由图象可判断,反应I正反应△H<0(填“>”、“<”或“=”)
④C点比B点所产生的NO的物质的量少的主要原因升高温度平衡逆向移动.
(4)羟胺(NH2OH)的电子式
 ,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
,羟胺是一种还原剂,现用25.00mL 0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是N2O.
15.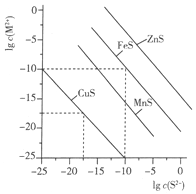 一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列有关判断不正确的是( )
一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列有关判断不正确的是( )
 一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列有关判断不正确的是( )
一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示.下列有关判断不正确的是( )| A. | 该温度下,Ksp(MnS)大于1.0×10-35 | |
| B. | 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀 | |
| C. | 向c(Fe2+)=0.1mol•L-1的溶液中加入CuS粉末,有FeS沉淀析出 | |
| D. | 该温度下,溶解度:CuS>MnS>FeS>ZnS |
14.25℃、101kPa下,煤炭、氢气、天然气和甲醇(CH3OH)四种燃料的热值(指一定条件下,单位质量的物质完全燃烧所放出的热量)依次是33kJ•g-1、143kJ•g-1、56kJ•g-1、23kJ•g-1.则下列热化学方程式正确的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-396 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=-286 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-896 kJ•mol-1 | |
| D. | CH3OH(l)+O2(g)=CO2(g)+2H2O (l)△H=-736 kJ•mol-1 |
13.下列微粒中含有配位键的是( )
①H3O+;②NH4+;③[Cu(H2O)4]2+;④[Fe(SCN)6]3-;⑤CuCl42-;⑥CH4;⑦NH3.
①H3O+;②NH4+;③[Cu(H2O)4]2+;④[Fe(SCN)6]3-;⑤CuCl42-;⑥CH4;⑦NH3.
| A. | ①②③④⑤ | B. | ①③⑥ | C. | ④⑤⑦ | D. | ②④⑥ |
12. 双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源.利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如图所示,M、N为离子交换膜.下列说法错误的是( )
双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源.利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如图所示,M、N为离子交换膜.下列说法错误的是( )
 双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源.利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如图所示,M、N为离子交换膜.下列说法错误的是( )
双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源.利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HC1,其工作原理如图所示,M、N为离子交换膜.下列说法错误的是( )| A. | 阴极室发生的反应为2H++2e-=H2↑ | |
| B. | M为阳离子交换膜,N为阴离子交换膜 | |
| C. | 若去掉双极膜(BP),阳极室会有C12生成 | |
| D. | 电路中每转移1mol电子,两极共得到0.5 mol气体 |
10.如图是利用乙烯催化氧化制备乙醛同时能获得电能的一种装置,下列说法错误的是( )
0 163486 163494 163500 163504 163510 163512 163516 163522 163524 163530 163536 163540 163542 163546 163552 163554 163560 163564 163566 163570 163572 163576 163578 163580 163581 163582 163584 163585 163586 163588 163590 163594 163596 163600 163602 163606 163612 163614 163620 163624 163626 163630 163636 163642 163644 163650 163654 163656 163662 163666 163672 163680 203614

| A. | 该装置可将化学能转化为电能 | |
| B. | 正极反应式为:O2+4e-+4H+═H2O | |
| C. | 每消耗 0.2 mol CH2=CH2,则溶液中有 0.4 mol e-迁移 | |
| D. | 放电一段时间后磷酸的物质的量不变 |


 ,A在一定条件下有如图所示的转化关系.
,A在一定条件下有如图所示的转化关系.
 ,写出所有符合下列要求的E的同分异构体的结构简式:
,写出所有符合下列要求的E的同分异构体的结构简式: 、
、 .
. .
.