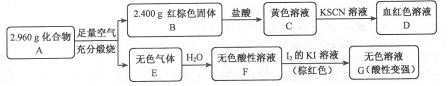
0 163281 163289 163295 163299 163305 163307 163311 163317 163319 163325 163331 163335 163337 163341 163347 163349 163355 163359 163361 163365 163367 163371 163373 163375 163376 163377 163379 163380 163381 163383 163385 163389 163391 163395 163397 163401 163407 163409 163415 163419 163421 163425 163431 163437 163439 163445 163449 163451 163457 163461 163467 163475 203614
 .写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑.
.写出该反应的离子方程式Fe3S4+6H+=3Fe2++S+3H2S↑.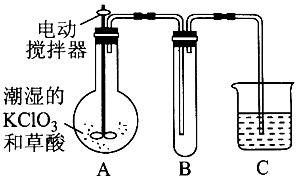


 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: 将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
将1mol I2(g) 和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示: 纳米级Fe粉是新型材料,具有超强磁性、高效催化性.某化学小组探究用氢气和碳酸亚铁制取纳米级铁粉.其实验设计如图(加热、支持装置省略)
纳米级Fe粉是新型材料,具有超强磁性、高效催化性.某化学小组探究用氢气和碳酸亚铁制取纳米级铁粉.其实验设计如图(加热、支持装置省略) 如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题: