3.下列离子方程式正确的是( )
| A. | 向Na[Al(OH)4]溶液中通入足量CO2:2[Al(OH)4]-+CO2═2Al(OH)3↓+CO32-+H2O | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2Na++2OH-═Na2SiO3+H2O | |
| C. | 铜和氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 碳酸钡和稀硝酸反应:CO32-+2H+═CO2↑+H2O |
2.在实验室中,下列除去杂质的方法不正确的是( )
| A. | 硝基苯中混有浓硝酸,加入足量稀NaOH溶液洗涤,振荡,用分液漏斗分液 | |
| B. | 乙烯中混有SO2、CO2,将其通入NaOH溶液洗气 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸氢钠溶液的洗气瓶 | |
| D. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 |
1.下列关于有机化合物的认识正确的是( )
| A. | 苯中加入溴水后溴水层颜色变浅,这是由于发生了取代反应 | |
| B. | 乙烯和苯分子中所有原子在同一平面上 | |
| C. | 一氯丙烷(C3H7Cl)的同分异构体共有3种 | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
20.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如图:

已知:1.Ksp( CaF2)=1.5×10-10Ksp(MgF2)=7.4×10-11Ksp(NiCO3)=1.42×10-7
2.流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:增大盐酸的浓度(或将镍废料研成粉末或延长浸泡时间等)(写出一种即可).
(2)加入H2O2时发生主要反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)“除铁”时,控制溶液pH的范围为3.2~7.1.
(4)滤渣B的主要成分的化学式为MgF2、CaF2.
(5)确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),保持溶液中c(CO32-)>0.142mol•L-1.
(6)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.

已知:1.Ksp( CaF2)=1.5×10-10Ksp(MgF2)=7.4×10-11Ksp(NiCO3)=1.42×10-7
2.流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(2)加入H2O2时发生主要反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)“除铁”时,控制溶液pH的范围为3.2~7.1.
(4)滤渣B的主要成分的化学式为MgF2、CaF2.
(5)确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),保持溶液中c(CO32-)>0.142mol•L-1.
(6)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
19.研究物质的微观结构,有助于人们理解物质变化的本质.请回答:
(1)C、N、O元素的第一电离能由大到小的顺序是N>O>C.
(2)A、B均为短周期金属元素.依据下表数据,
写出B原子的电子排布式1s22s22p63s2.
(3)①COCl2分子的结构式为 ,COCl2分子内含有D(填标号);
,COCl2分子内含有D(填标号);
A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3 个σ键、1个π键
(4)甲苯结构简式: ,其中C原子采用的轨道杂化方式有sp2、sp3.
,其中C原子采用的轨道杂化方式有sp2、sp3.
(5)ClO3-离子的立体构型是三角锥形,写出一种与ClO3-互为等电子体的微粒的化 学式SO32-(IO3-BrO3-NCl3).
(6)比较C、Si、N元素形成简单的氢化物稳定性高低并说明理由稳定性:NH3>CH4>SiH4,因为键长N-H<C-H<Si-H,又键长越短,键能越大,所以稳定性
为NH3>CH4>SiH4.
(1)C、N、O元素的第一电离能由大到小的顺序是N>O>C.
(2)A、B均为短周期金属元素.依据下表数据,
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(3)①COCl2分子的结构式为
 ,COCl2分子内含有D(填标号);
,COCl2分子内含有D(填标号);A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3 个σ键、1个π键
(4)甲苯结构简式:
 ,其中C原子采用的轨道杂化方式有sp2、sp3.
,其中C原子采用的轨道杂化方式有sp2、sp3.(5)ClO3-离子的立体构型是三角锥形,写出一种与ClO3-互为等电子体的微粒的化 学式SO32-(IO3-BrO3-NCl3).
(6)比较C、Si、N元素形成简单的氢化物稳定性高低并说明理由稳定性:NH3>CH4>SiH4,因为键长N-H<C-H<Si-H,又键长越短,键能越大,所以稳定性
为NH3>CH4>SiH4.
18.下列物质的分子中既有σ键,又有π键的是( )
| A. | HCl | B. | H2O2 | C. | H2O | D. | N2 |
17.给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{Ba(NO_{3})_{2}}{→}$BaSO4 | |
| B. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3(aq) | |
| C. | MgCl2•6H2O$\stackrel{△}{→}$MgCl2$\stackrel{电解}{→}$Mg | |
| D. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
14.25℃时,下列有关电解质溶液的说法错误的是( )
0 162977 162985 162991 162995 163001 163003 163007 163013 163015 163021 163027 163031 163033 163037 163043 163045 163051 163055 163057 163061 163063 163067 163069 163071 163072 163073 163075 163076 163077 163079 163081 163085 163087 163091 163093 163097 163103 163105 163111 163115 163117 163121 163127 163133 163135 163141 163145 163147 163153 163157 163163 163171 203614
| A. | pH=9.25、浓度均为0.1 mol•L-1的NH4C1、NH3•H2O混合溶液:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| B. | 0.1mol/LH2SO4溶液与0.1mol/LNaOH溶液等体积混合:c(H+)═c(SO42-)+c(OH-) | |
| C. | 向0.10mol•L-1NaHSO3溶液中通NH3至pH=7:c(Na+)>c(SO32-)>c(NH4+) | |
| D. | CO2通入KOH溶液,当由水电离的H+浓度为10-7mol/L,一定存在:c(K+)=2c(CO32-)+c(HCO3-) |



 $→_{②H+}^{①浓KOH、△}$
$→_{②H+}^{①浓KOH、△}$ +
+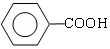
 .
. ,该反应的反应类型是缩聚反应.
,该反应的反应类型是缩聚反应. +4Ag(NH3)2++4OH-$\stackrel{△}{→}$
+4Ag(NH3)2++4OH-$\stackrel{△}{→}$ +2NH4++6NH3+4Ag↓+2H2O.
+2NH4++6NH3+4Ag↓+2H2O. 中任意一种.
中任意一种. .
.