题目内容
【题目】A~H等8种物质存在如下转化关系(反应条件及部分产物未标出)。已知:A是正盐,B是能使品红溶液褪色的气体;G是红棕色气体。按要求回答问题:
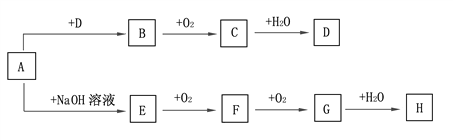
(1)写出下列物质的化学式:A. ___________, B.____________, C.____________。
(2)A→B的离子方程式:________________________________________;
E→F的化学方程式:__________________________________________;
H的浓溶液与铜反应的离子方程式:_______________________________。
(3)检验某溶液中含D中阴离子的方法是_________________________________。
【答案】 (NH4)2SO3 SO2 SO3 SO32-+2H+===SO2↑+H2O 4NH3+5O2![]() 4NO+6H2O Cu+4H++2NO3- ===Cu2++2NO2↑+2H2O 取少量该溶液于试管中,加足量盐酸酸化,未见白色沉淀产生;再加少量BaCl2溶液,出现白色沉淀,则证明有SO42-
4NO+6H2O Cu+4H++2NO3- ===Cu2++2NO2↑+2H2O 取少量该溶液于试管中,加足量盐酸酸化,未见白色沉淀产生;再加少量BaCl2溶液,出现白色沉淀,则证明有SO42-
【解析】G是红棕色气体,则G是NO2,F和氧气反应生成二氧化氮,所以F是NO;A是正盐,和氢氧化钠反应生成E,E和氧气反应生成NO,则E是NH3,A是铵盐;二氧化氮和水反应后能生成H为硝酸;B能使品红溶液褪色,且B能和氧气反应生成C,所以B是SO2,C是SO3,三氧化硫和水反应生成D为硫酸,A是正盐且是铵盐,反应后能生成二氧化硫,所以A是(NH4)2SO3。
(1)由上述分析可知,A为(NH4)2SO3,B为SO2,C是SO3,故答案为:(NH4)2SO3;SO2;SO3;
(2)A→B是亚硫酸根离子与酸反应生成二氧化硫,反应的离子方程式为SO32-+2H+=SO2↑+H2O;E→F是在催化剂、加热条件下,氨气和氧气反应生成一氧化氮和水,反应方程式为:4NH3+5O2![]() 4NO+6H2O;H为硝酸,加热条件下,铜和浓硝酸反应生成二氧化氮、硝酸铜和水,反应的离子方程式为:Cu+4H++2NO3- =Cu2++2NO2↑+2H2O,故答案为:SO32-+2H+=SO2↑+H2O;4NH3+5O2
4NO+6H2O;H为硝酸,加热条件下,铜和浓硝酸反应生成二氧化氮、硝酸铜和水,反应的离子方程式为:Cu+4H++2NO3- =Cu2++2NO2↑+2H2O,故答案为:SO32-+2H+=SO2↑+H2O;4NH3+5O2![]() 4NO+6H2O;Cu+4H++2NO3- =Cu2++2NO2↑+2H2O;
4NO+6H2O;Cu+4H++2NO3- =Cu2++2NO2↑+2H2O;
(3)检验某溶液中是否含D(硫酸)中阴离子的方法是:取少量该溶液于试管中,加足量盐酸酸化,未见白色沉淀,然后加入氯化钡溶液有白色沉淀,说明含有硫酸根离子,故答案为:取少量该溶液于试管中,加足量盐酸酸化,未见白色沉淀,然后加入氯化钡溶液有白色沉淀,说明含有硫酸根离子。

