题目内容
16.在无色透明的酸性溶液中,能大量共存的离子组是( )| A. | Na+、Al3+、NO3-、SO42- | B. | K+、Na+、CO32-、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | K+、Mg2+、I-、NO3- |
分析 无色溶液中不存在Cu2+、Fe2+、Fe3+、MnO4-等有色离子,酸性溶液中存在大量氢离子,
A.四种离子之间不反应,都不与氢离子反应,且为无色溶液;
B.碳酸根离子与酸性溶液中的氢离子反应;
C.高锰酸根离子为有色离子,不满足溶液无色的条件;
D.酸性条件下,硝酸根离子能够氧化碘离子.
解答 解:溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,酸性溶液中存在大量氢离子,
A.Na+、Al3+、NO3-、SO42-之间不发生反应,都不与氢离子反应,且都是无色离子,在溶液中能够大量共存,故A正确;
B.CO32-与氢离子反应,在溶液中不能大量共存,故B错误;
C.MnO4-为有色离子,不满足溶液无色的要求,故C错误;
D.I-、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,题目难度中等,注意掌握离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识的能力.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
7.下列依据相关实验得出的结论正确的是( )
| 编号 | 实验 | 结论 |
| A | 向某溶液中加入稀盐酸,将产生的气体通入澄清石灰水,石灰水变浑浊 | 该溶液一定是碳酸盐溶液 |
| B | 用铂丝蘸取少量某溶液在酒精灯火焰上进行焰色反应,火焰呈黄色 | 该溶液不一定是钠盐溶液 |
| C | 往淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液并水浴加热,无银镜出现 | 该淀粉未发生水解 |
| D | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色 | 该溶液中一定含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
4.化学与社会生活密切相关,下列说法正确的是( )
| A. | 体积分数为95%的酒精通常作为医用酒精 | |
| B. | 石油的分馏、煤的气化、海水的提镁都包含化学变化 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 利用高纯度硅制造的太阳能电池板可将光能直接转化为电能 |
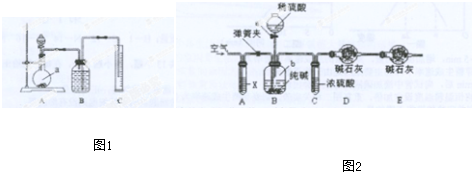
11.教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1(KMnO4溶液已熔化)
(1)写出草酸溶于水的电离方程式:H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-.
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是:①<②(填:>、<、=).
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0056mol/L.
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.
(5)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+(或MnSO4)是反应的催化剂②该反应放热.
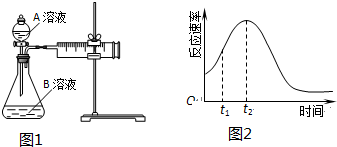
| 实验序号 | 温度T/℃ | A溶液 | B溶液 |
| ① | 30 | 20mL0.1mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
| ② | 20 | 20mL0.1mol•L-1H2S2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是:①<②(填:>、<、=).
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0056mol/L.
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.
(5)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+(或MnSO4)是反应的催化剂②该反应放热.

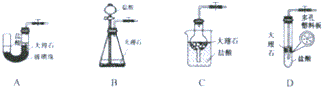
1.拟用如图装置制取如下表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热,a、b、c、d表示相应仪器中加入的试剂).能达到实验目的是( )
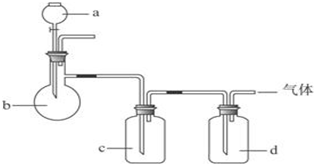

| 选项 | 气体 | a | b | c | d |
| A | SO2 | 硫酸 | 亚硫酸钠 | 浓硫酸 | NaOH溶液 |
| B | NH3 | 浓氨水 | 消石灰 | 浓硫酸 | H2O |
| C | O2 | 双氧水 | MnO2 | H2O | 浓硫酸 |
| D | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
8.下列物质的电子式书写正确的是( )
| A. |  | B. | 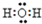 | C. | 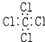 | D. | 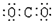 |
5.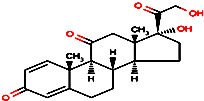 2014年广东省发现登革热病例.登革热是由登革热病毒引起的一种急性发热性疾病,其特征为发热、关节痛、肌肉痛、皮疹、淋巴结肿大和白细胞减少.对高热不退及毒血症状严重者,可短期应用小剂量肾上腺皮质激素,如口服泼尼松.泼尼松的结构简式如图所示,下列有关它的说法正确的是( )
2014年广东省发现登革热病例.登革热是由登革热病毒引起的一种急性发热性疾病,其特征为发热、关节痛、肌肉痛、皮疹、淋巴结肿大和白细胞减少.对高热不退及毒血症状严重者,可短期应用小剂量肾上腺皮质激素,如口服泼尼松.泼尼松的结构简式如图所示,下列有关它的说法正确的是( )
 2014年广东省发现登革热病例.登革热是由登革热病毒引起的一种急性发热性疾病,其特征为发热、关节痛、肌肉痛、皮疹、淋巴结肿大和白细胞减少.对高热不退及毒血症状严重者,可短期应用小剂量肾上腺皮质激素,如口服泼尼松.泼尼松的结构简式如图所示,下列有关它的说法正确的是( )
2014年广东省发现登革热病例.登革热是由登革热病毒引起的一种急性发热性疾病,其特征为发热、关节痛、肌肉痛、皮疹、淋巴结肿大和白细胞减少.对高热不退及毒血症状严重者,可短期应用小剂量肾上腺皮质激素,如口服泼尼松.泼尼松的结构简式如图所示,下列有关它的说法正确的是( )| A. | 分子式为C21H22O5 | |
| B. | 属于芳香族化合物 | |
| C. | 1mol该物质最多能与5molH2发生加成反应 | |
| D. | 该物质能发生加成、取代、氧化、水解等反应 |
6.将2molA与2molB混合于2L的密闭容器中,发生如下反应:2A(g)+3B(g)?2C(g)+xD(g),2min后达到平衡时,A的转化率为50%,测得v(D)=0.25mol/(L•min).下列推断正确的是( )
| A. | v(C)=0.5mol/(L•min) | B. | x=3 | ||
| C. | B的转化率为25% | D. | 平衡时C的体积分数为28.6% |
 硫酸钠与工农业生产、生活紧密相关,工业硫酸钠大多采用侯氏制碱法制取.
硫酸钠与工农业生产、生活紧密相关,工业硫酸钠大多采用侯氏制碱法制取.