题目内容
某中学研究性学生小组的同学对牛奶中的蛋白质进行分析实验:取30 mL牛奶(密度为盖尔达法:蛋白质![]() 硫酸铵
硫酸铵![]() 氨
氨
求:(1)30 mL牛奶中含有多少克氮?
(2)如果蛋白质中氮元素的质量分数为16.8 %,则牛奶中含蛋白质的质量分数为多少?
解析:(1)依据氮原子守恒找关系式:N—NH3
2NH3+H2SO4![]() (NH4)2SO4
(NH4)2SO4
2NaOH+H2SO4![]() Na2SO4+2H2O
Na2SO4+2H2O
30 mL牛奶中含氮
(0.5 mol·L-1×![]() L-1 mol·L-1×
L-1 mol·L-1×![]() L×
L×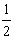 )×2×
)×2×
(2)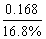 =
=
则牛奶中含蛋白质的质量分数为
![]() ×100%=3.24 %。
×100%=3.24 %。
答案:(1)

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
 的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)
的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)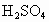 、品红溶液、澄清石灰水、
、品红溶液、澄清石灰水、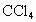 、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓
、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓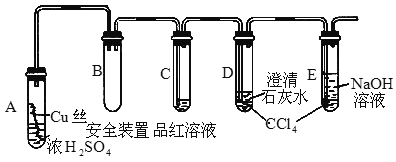

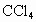 的作用是________.
的作用是________.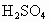 和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀.学生1猜想是由于
和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀.学生1猜想是由于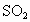 溶解度较大,生成了
溶解度较大,生成了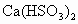 的缘故.请你设计实验验证学生1的猜想_______________________________________________.
的缘故.请你设计实验验证学生1的猜想_______________________________________________.