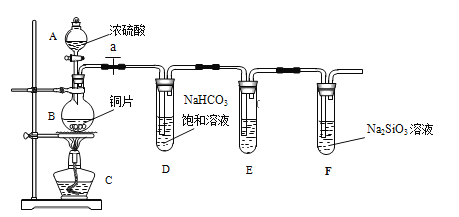
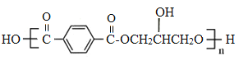题目内容
【题目】(题文)氯碱工业中电解饱和食盐水流程及原理示意图如下图所示。
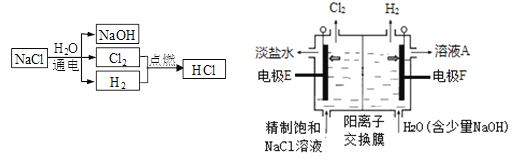
(1)生成H2的电极反应式是_________________________________________。
(2)Na+向________(填“E”或“F”)方向移动,溶液A的溶质是______________。
(3)电解饱和食盐水总反应的离子方程式是_____________________________。
(4)常温下,将氯碱工业的附属产品盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表。
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液pH |
① | 0.1 | 0.1 | pH=5 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>7 |
ⅰ. 实验①中所得混合溶液,由水电离出的c(H+)=______ mol·L-1。
ⅱ. 实验②中,c______0.2(填“>”“<”或“=”)。
ⅲ. 实验③中所得混合溶液,各离子浓度由大到小的顺序是__________________。
ⅳ. 实验①、③所用氨水中的![]() :①___________③(填“>”“<”或“=”)。
:①___________③(填“>”“<”或“=”)。
(5)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中的Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如下图所示。

下列表述正确的是_______。
A. 氯处理饮用水时,在夏季的杀菌效果比在冬季好
B. 在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C. 用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时效果差
【答案】![]() FNaOH2Cl-+2H2O
FNaOH2Cl-+2H2O![]() H2↑+Cl2↑+2OH-10-5>c(NH4+)>c(Cl-)>c(OH-)>c(H+)>C
H2↑+Cl2↑+2OH-10-5>c(NH4+)>c(Cl-)>c(OH-)>c(H+)>C
【解析】
电解饱和食盐水,氯离子在阳极(E极)失去电子生成氯气,水电离的H+在阴极(F极)得电子生成氢气,同时生成OH-,离子方程式是2Cl-+2H2O![]() H2↑+Cl2↑+2OH-.
H2↑+Cl2↑+2OH-.
(1)由装置图中氯气和氢气的位置判断,生成氢气的极为阴极,水电离的H+在阴极得电子生成氢气,电极反应式为![]() ;
;
破坏水的电离平衡,浓度增大,溶液A为氢氧化钠溶液,故溶质为NaOH.
(2)电解池中阳离子向阴极移动,所以Na+向F极移动,在F极水电离的H+得电子生成氢气,破坏水的电离平衡,OH-浓度增大,溶因此液A为氢氧化钠溶液,故溶质为NaOH;
(3)电解饱和食盐水,氯离子在阳极失去电子生成氯气,水电离的H+在阴极得电子生成氢气,同时生成OH-,离子方程式是2Cl-+2H2O![]() H2↑+Cl2↑+2OH-;
H2↑+Cl2↑+2OH-;
(4)ⅰ.从第①组情况分析,生成了氯化铵溶液,铵离子水解,溶液显示酸性,溶液中的氢离子是水电离的,故中由水电离出的c(H+)=1×10-5 mol·L-1;
ⅱ. 从第②组情况表明, pH=7,溶液显示中性,若c=2,生成氯化铵溶液,显示酸性,故氨水的浓度稍大些,即c大于0.2mol/L;
ⅲ. 0.2 mol/L的氨水与0.1mol/L的盐酸等体积混合后,得到等浓度的一水合氨与氯化铵的混合溶液,溶液 pH>7,说明氨水的电离程度大于水解程度,故铵离子浓度大于氨水浓度;,所以c(NH4+)>c(Cl-)>c(OH-)>c(H+);
ⅳ. NH3·H2O是弱电解质,在溶液中存在电离平衡,NH3·H2O![]() NH4++OH-,电离平衡常数
NH4++OH-,电离平衡常数![]() ,则
,则![]() ,增大NH3·H2O的浓度,电离平衡正向移动,OH-浓度增大,实验①、③相比较,③中OH-浓度大,OH-浓度越大,
,增大NH3·H2O的浓度,电离平衡正向移动,OH-浓度增大,实验①、③相比较,③中OH-浓度大,OH-浓度越大, ![]() 越小,所以①>③;
越小,所以①>③;
(5)A、夏季温度较高,氯气溶解度随温度的升高而降低,且HClO的电离是吸热的,升高温度平衡正向移动,水中HClO浓度减小,杀毒效果差,故A错误。
B、根据电荷守恒可以得到c(OH-)+c(ClO-)=c(H+),故B错误;
C、由于HClO的杀菌能力比ClO-强,因此HClO的浓度越高,杀菌能力越强,由图中可知pH=6.5时的次氯酸浓度更大,故C正确;
综上所述,本题正确答案为C。

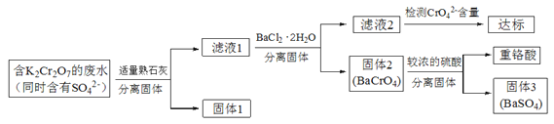
【题目】含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有K2Cr2O7的废水并回收重铬酸,具体的流程如下:
已知:i. CaCr2O7、BaCr2O7易溶于水,其它几种盐在常温下的溶度积如下表所示。
物质 | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
溶度积 |
|
|
|
|
ii. Cr2O72-+ H2O![]() 2 CrO42-+ 2H+
2 CrO42-+ 2H+
(1)向滤液1中加入BaCl2·H2O的目的,是使CrO42-从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用是_______________________________。
②结合表中数据,说明选用Ba2+而不选用Ca2+处理废水的理由是________________。
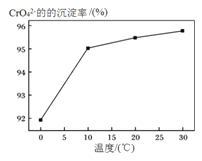
③研究温度对CrO42-沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下CrO42-的沉淀率![]() ,
,
如下图所示。
已知:BaCrO4(s) ![]() Ba2+ (aq) + CrO42-(aq)
Ba2+ (aq) + CrO42-(aq)
CrO42-的沉淀效率随温度变化的原因是___________________________________。
(2)向固体2中加入硫酸,回收重铬酸。
① 硫酸浓度对重铬酸的回收率如下图(左)所示。结合化学平衡移动原理,解释使用0.450 mol/L的硫酸时,重铬酸的回收率明显高于使用0.225 mol/L的硫酸的原因是_________________________________。
② 回收重铬酸的原理如下图(右)所示。当硫酸浓度高于0.450 mol/L时,重铬酸的回收率没有明显变化,其原因是_______________________________。
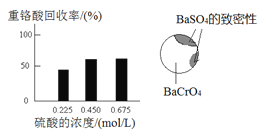
(3)综上所述,沉淀BaCrO4并进一步回收重铬酸的效果与___________有关。
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A 9.0 ,升温使其汽化,测其密度是相同条件下氢气的45倍。 | (1)A的相对分子质量为:___________。 |
(2)将此9.0 gA在足量纯氧气中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g。 | (2)A的分子式为:_______________________。 |
(3)另取A 9.0 g,跟足量的碳酸氢钠粉末反应,生成2.24 LCO2(标准状况),若与足量金属钠反应则生成2.24 L氢气(标准状况)。 | (3)写出A中含有的官能团:____、_____。 |
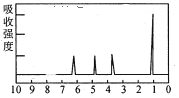
(4)A的核磁共振氢谱如下图:
| (4)A中含有______种氢原子。 |
(5)综上所述A的结构简式_______________________。 | |