题目内容
15.符合如图的反应是(T1T2是表示不同的温度)( )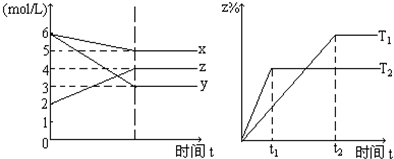
| A. | X+3Y?2Z 正反应为吸热反应 | B. | X+3Y?2Z 正反应为放热反应 | ||
| C. | X+2Y?3Z 正反应为放热反应 | D. | 5Z+3Y?4Z 正反应为放热反应 |
分析 根据左图知,随着反应进行,X、Y的物质的量浓度降低而Z的物质的量浓度增大,则X、Y是反应物,Z是生成物,反应达到平衡状态时,c(X)=(6-5)mol/L=1mol/L、c(Y)=(6-3)mol/L=3mol/L、c(Z)=(4-2)mol/L=2mol/L,同一可逆反应中同一时间段内各物质浓度变化量之比等于其计量数之比,据此确定X、Y、Z的计量数之比;
右图中,根据“先拐先平数值大”知,温度T1<T2,升高温度,Z的百分含量降低,说明平衡逆向移动,升高温度平衡向吸热反应方向移动,据此判断反应热.
解答 解:根据左图知,随着反应进行,X、Y的物质的量浓度降低而Z的物质的量浓度增大,则X、Y是反应物,Z是生成物,反应达到平衡状态时,c(X)=(6-5)mol/L=1mol/L、c(Y)=(6-3)mol/L=3mol/L、c(Z)=(4-2)mol/L=2mol/L,同一可逆反应中同一时间段内各物质浓度变化量之比等于其计量数之比,则X、Y、Z的计量数之比=1mol/L:3mol/L:2mol/L=1:3:2,所以该反应方程式为X+3Y?2Z;
右图中,根据“先拐先平数值大”知,温度T1<T2,升高温度平衡向吸热反应方向移动,升高温度,Z的百分含量降低,说明平衡逆向移动,则正反应是放热反应,
故选B.
点评 本题考查图象分析,为高频考点,明确图中纵横坐标含义、曲线变化趋势及拐点含义是解本题关键,采用“先拐先平数值大”的方法确定反应热,题目难度不大.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
14.下列叙述中,正确的是( )
| A. | 标准状况下,22.4L水所含的原子数目为3NA | |
| B. | 一定条件下,等物质的量甲烷和一氧化碳所含的分子数可能不相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 标准状况下,17g氨气的体积约为22.4L |
3.下列各项中表达正确的是( )
| A. | 氮气的分子式:N≡N | B. | Na+结构示意图是: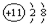 | ||
| C. | 乙醇的结构简式C2H6O | D. | HClO的电子式: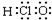 |
20.常温下,下列各组微粒在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1 Fe(NO3)3溶液中:Mg2+、H+、SO42-、Cl- | |
| B. | 0.1 mol•L-1 KClO溶液中:Na+、H+、Cl-、NO3- | |
| C. | 0.1 mol•L-1氨水中:Ba2+、Ag+、NH4+、NO3- | |
| D. | c(OH-)=10-13 mol•L-1的溶液中:MnO4-、Na+、Br-、CH3CHO |
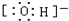 B
B E
E
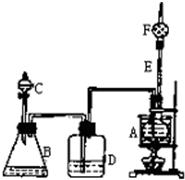 如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水CuSO4粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中均盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,浓H2SO4缓缓流入B中,D中导管口有气泡产生.过几分钟后,无水CuSO4变蓝,此时水浴加热,点燃F管口的气体,观察到绿色的火焰.试回答:
如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水CuSO4粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中均盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,浓H2SO4缓缓流入B中,D中导管口有气泡产生.过几分钟后,无水CuSO4变蓝,此时水浴加热,点燃F管口的气体,观察到绿色的火焰.试回答: