题目内容
银锌碱性蓄电池是一种可以反复充电、放电的装置.电池放电时的反应原理是:Zn+Ag2O+H2O=2Ag+Zn(OH)2
现用该蓄电池电解含有0.04mol CuSO4和0.04mol NaCl的混合溶液400mL,工作一段时间后测得蓄电池消耗了0.72g H2O(电解池的电极均为惰性电极).列叙述不正确的是( )
A.该电池负极反应为Ag2O+H2O+2e-═2Ag+2OH-
B.阳极产生的气体在标准状况下为0.448 L
C.阴极析出铜为2.56g
D.电解后溶液的 pH=1(溶液的体积变化忽略不计)
【答案】分析:A、依据电池反应,负极是元素化合价升高失电子发生的氧化反应;
B、电解混合溶液,阳极是氯离子和氢氧根离子放电,结合电极反应计算;
C、阴极是铜离子得到电子析出铜,依据电子守恒计算析出铜的质量;
D、根据转移电子守恒计算阴极上析出的物质,再根据氧气计算生成的C(H+),从而得出其pH;
解答:解:A、负极是元素化合价升高失电子发生的氧化反应,放电是原电池反应,Zn+Ag2O+H2O=2Ag+Zn(OH)2,负极是锌失电子发生氧化反应,电极反应为:
Zn-2e-+2OH-=Zn(OH)2;故A错误;
B、电解含有0.04mol CuSO4和0.04mol NaCl的混合溶液400mL,工作一段时间后测得蓄电池消耗了0.72g H2O物质的量=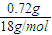 =0.04mol,2H2O=2H2↑+O2↑,生成的氧气为0.02mol,生成氢气物质的量为0.04mol,阳极电极反应是氯离子和氢氧根离子放电生成氯气和氧气,2Cl--2e-=Cl2↑,生成氯气物质的量为0.08mol,阳极生成的气体物质的量为0.12mol;标准状况体积为0.12mol×22.4L/mol=2.688L,故B错误;
=0.04mol,2H2O=2H2↑+O2↑,生成的氧气为0.02mol,生成氢气物质的量为0.04mol,阳极电极反应是氯离子和氢氧根离子放电生成氯气和氧气,2Cl--2e-=Cl2↑,生成氯气物质的量为0.08mol,阳极生成的气体物质的量为0.12mol;标准状况体积为0.12mol×22.4L/mol=2.688L,故B错误;
C、依据电极反应电子守恒,阳极反应:
2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑,
2 2 4 1
0.04mol 0.04mol 0.08mol 0.02mol
转移电子总数为0.12mol
阴极电极反应:
Cu2++2e-=Cu 4H++4e-=2H2↑
1 2 1 4 2
0.04mol 0.08mol 0.04mol 0.08mol 0.04mol
阴极析出铜质量=0.04mol×64g/mol=2.56g;故C正确;
D、依据C计算结合电子守恒得到,氢氧根离子失电子多出0.04mol,氢离子增加0.04mol,c(H+)=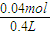 0.1mol/L,PH=1,故D正确;
0.1mol/L,PH=1,故D正确;
故选AB
点评:本题考查了电解原理的分析计算,电子守恒的计算应用和溶液中离子放电顺序是解题关键,题目难度较大.
B、电解混合溶液,阳极是氯离子和氢氧根离子放电,结合电极反应计算;
C、阴极是铜离子得到电子析出铜,依据电子守恒计算析出铜的质量;
D、根据转移电子守恒计算阴极上析出的物质,再根据氧气计算生成的C(H+),从而得出其pH;
解答:解:A、负极是元素化合价升高失电子发生的氧化反应,放电是原电池反应,Zn+Ag2O+H2O=2Ag+Zn(OH)2,负极是锌失电子发生氧化反应,电极反应为:
Zn-2e-+2OH-=Zn(OH)2;故A错误;
B、电解含有0.04mol CuSO4和0.04mol NaCl的混合溶液400mL,工作一段时间后测得蓄电池消耗了0.72g H2O物质的量=
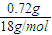 =0.04mol,2H2O=2H2↑+O2↑,生成的氧气为0.02mol,生成氢气物质的量为0.04mol,阳极电极反应是氯离子和氢氧根离子放电生成氯气和氧气,2Cl--2e-=Cl2↑,生成氯气物质的量为0.08mol,阳极生成的气体物质的量为0.12mol;标准状况体积为0.12mol×22.4L/mol=2.688L,故B错误;
=0.04mol,2H2O=2H2↑+O2↑,生成的氧气为0.02mol,生成氢气物质的量为0.04mol,阳极电极反应是氯离子和氢氧根离子放电生成氯气和氧气,2Cl--2e-=Cl2↑,生成氯气物质的量为0.08mol,阳极生成的气体物质的量为0.12mol;标准状况体积为0.12mol×22.4L/mol=2.688L,故B错误;C、依据电极反应电子守恒,阳极反应:
2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑,
2 2 4 1
0.04mol 0.04mol 0.08mol 0.02mol
转移电子总数为0.12mol
阴极电极反应:
Cu2++2e-=Cu 4H++4e-=2H2↑
1 2 1 4 2
0.04mol 0.08mol 0.04mol 0.08mol 0.04mol
阴极析出铜质量=0.04mol×64g/mol=2.56g;故C正确;
D、依据C计算结合电子守恒得到,氢氧根离子失电子多出0.04mol,氢离子增加0.04mol,c(H+)=
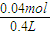 0.1mol/L,PH=1,故D正确;
0.1mol/L,PH=1,故D正确;故选AB
点评:本题考查了电解原理的分析计算,电子守恒的计算应用和溶液中离子放电顺序是解题关键,题目难度较大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
 现用该蓄电池电解c(NO3-)=6mol?L-1的KNO3和Cu(NO3)2的混合溶液500mL,当通电一段时间后,两极均收集到22.4L气体(标准状况)(电解池的电极均为石墨电极).
现用该蓄电池电解c(NO3-)=6mol?L-1的KNO3和Cu(NO3)2的混合溶液500mL,当通电一段时间后,两极均收集到22.4L气体(标准状况)(电解池的电极均为石墨电极).