题目内容
反应N2O4(g)
 2NO2(g);△H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是( )
2NO2(g);△H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示。下列说法正确的是( )
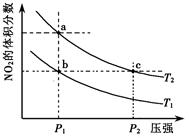
A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a浅,c深
C.b、c两点的转化率:b>c
D.由b点到a点,可以用加热的方法
D
【解析】
试题分析:根据图像可知,a、c两点都在等温线上,a点压强小于c点压强,所以c点反应速率大于a点反应速率,A不正确;正方应是体积减小的可逆反应,则增大压强平衡向逆反应方向移动,NO2的浓度降低,颜色变浅,B不正确;b、c两点的NO2含量相同,转化率相同,C不正确。由b点到a点,NO2的含量增大,说明平衡向正反应方向移动。易于正方应是吸热反应,所以可以用加热的方法,D正确,答案选D。
考点:查外界条件对平衡状态的影响、图像识别
点评:该题是中等难度的试题,主要是考查学生对可逆反应图像识别的掌握情况,意在培养学生的逻辑推理能力,提升的学生的学科素养。该题的关键是明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”即可解答。

化工行业的发展必须符合国家节能减排的总体要求。请回答下列问题:
(1)已知C(s)+H2O(g) CO(g)+H2(g),则该反应的平衡常数表达式为 。
CO(g)+H2(g),则该反应的平衡常数表达式为 。
(2)已知在一定温度下,
C(s)+CO2(g)
 2CO(g)
△H1
2CO(g)
△H1
CO(g)+H2O(g)
 H2(g)+CO2(g)
△H2
H2(g)+CO2(g)
△H2
C(s)+H2O(g) CO(g)+H2(g) △H3
CO(g)+H2(g) △H3
则△H1、△H2、△H3之间的关系是: 。
(3)通过研究不同温度下平衡常数可以解决某些实际问题。已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应: CO(g)+H2O(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
则该反应的正反应方向是 反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为 。
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。对反应N2O4(g)  2NO2(g)
△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
2NO2(g)
△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用下图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为: ,阳极区逸出气体的成分为 (填化学式)。

 2NO2(g) ΔH=+52.70 kJ·mol—1。
2NO2(g) ΔH=+52.70 kJ·mol—1。
 2NO2(g);ΔH=+57 kJ·mol-1,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g);ΔH=+57 kJ·mol-1,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )