题目内容
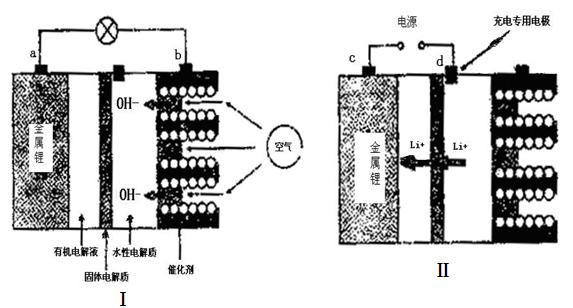
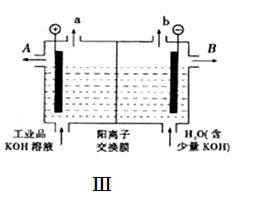
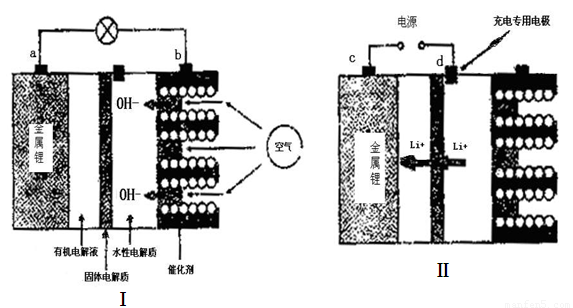
锂——空气电池能够提供相当于普通锂离子电池l0倍的能量,因此它是最有前途的电池技术。下图是锂——空气电池放电和充电时的工作示意图。
(1)图I中电极a是 极。
(2)电池中间的固体电解质(含阳离子交换膜)还能阻止H2O、N2、O2等物质的通过防止Li和这些物质反应。Li和水在常温下发生反应的化学方程式为 。
(3)当给图Ⅱ中的锂空气电池充电时,d极应接电源的 极,该电极的电极反应式为 。
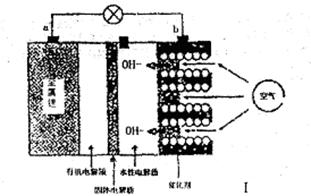
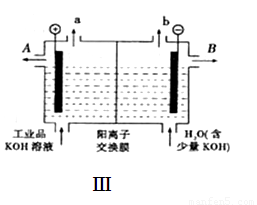
(4)可用石墨为电极,用该电池电解提纯氢氧化钾电解液。电解池内的阳离子交换膜只允许阳离子通过,其工作原理如图Ⅲ所示。
①该电解池的阴极反应式为 ;
②除去杂质后的氢氧化钾溶液从出口 (填“A”或“B”)导出;
(1)负(2分)
(2)2Li+2H2O 2LiOH+H2↑(3分)
(3)正(2分) 4OH—4e- 2H2O+O2↑(3分)
(4)①2H+ +2e-=H2↑(3分) ②B (2分)
解析:略

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目