题目内容
【题目】废旧无汞碱性锌锰电池可用于制造隐形战机的机身涂料MnxZn(1-x)Fe2O4,该电池工作反应原理为Zn+2MnO2+2H2O![]() 2MnO(OH)+Zn(OH)2。某化学小组利用废电池制涂料的工艺如下:
2MnO(OH)+Zn(OH)2。某化学小组利用废电池制涂料的工艺如下:
A.浸取:将去除表面塑料的旧电池加入水中浸取并过滤,滤液经操作a得KOH固体;
B.溶液:滤渣中加入过量稀硫酸和足量双氧水,至不再出现气泡时,过滤;
C.测成分:测步骤B中滤液成分,然后加入铁粉;
D.氧化:加入双氧水氧化;
E.调pH:滴加氨水调pH,经结晶处理得MnxZn(1-x)Fe2O4。
(1)浸取时的操作有 ______。
A.拆解、粉碎旧电池 B.降低温度 C.搅拌 D.加压
(2)操作a为________。
(3)溶渣时生成Mn2+的主要离子方程式为______________________________。
(4)若步骤C测得滤液中金属离子组成为:c(Mn2+) +c(Zn2+) =0.8mol/L, c(Fe2+ ) = 0. 1 mol/L。若滤液体积为lm3,要合成MnxZn(1-x)Fe2O4,需加入Fe粉质量为___________kg(忽略体积变化)。
(5)氧化时,因为分解所需双氧水的量比理论值大得多。其原因可能是①温度过高;②______。
(6)最后一步结晶时,处理不当易生成MnFe2O4和ZnFe2O4。要制得MnxZn(1-x)Fe2O4,最后一步结晶时需注意______________________。
(7)某小组构想用ZnSO4、MnSO4溶液为原料,以Fe作电极用电解法经过一系列步骤制得MnxZn(1-x)Fe2O4,则开始电解时阳极反应式为___________________________________。
【答案】 A C 蒸发至有晶胶产生停止加热 2MnO(OH)+H2O2+4H+==2Mn2++O2↑+4H2O 84 生成Fe3+起催化作用促使H2O2分解 均匀结晶(或搅拌均匀) Fe-2e-=Fe2+
【解析】本题考查化学工艺流程,(1)浸取时,需要拆解、粉碎电池,为了加速溶解,需要进行搅拌,故选项A和C正确;(2)KOH溶于水,从滤液中得到KOH,需要进行蒸发至有晶胶产生,停止加热;(3)根据步骤B,滤渣中加入硫酸和足量的双氧水,双氧水的目的是还原+3价Mn,本身被氧化成O2,因此离子反应式为MnO(OH)+H++H2O2→Mn2++H2O+O2↑,Mn的化合价由+3价→+2价,化合价降低1价,H2O2中O共升高2价,最小公倍数为2,然后根据原子守恒和电荷守恒,离子反应方程式为:2MnO(OH)+4H++H2O2=2Mn2++4H2O+O2↑;(4)根据合成物质,得出Zn2+和Mn2+物质的量总和与Fe原子物质的量之比为1:2,因此有0.8×103/[0.1×103+n(Fe)]=1:2,解得n(Fe)=1.5×103mol,即质量为84kg;(5)氧化时,把Fe2+氧化成Fe3+,Fe3+作催化剂,使H2O2分解;(6)均匀结晶或搅拌均匀;(7)因为制备的物质中含有铁元素,因此需要铁电极放电,即铁电极作阳极,电极反应式为Fe-2e-=Fe2+。

 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
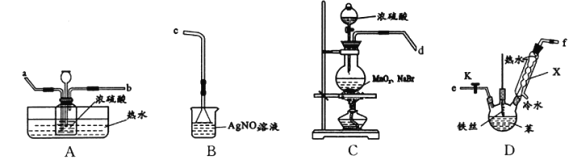
激活思维优加课堂系列答案【题目】某化学活动小组设计以下装置进行不同的实验。
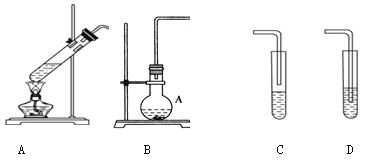
已知苯、溴苯的有关物理性质如下表:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
在水中的溶解度 | 微溶 | 微溶 | 微溶 |
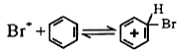
(1)若小组同学欲用装置A、C制备溴苯,则A中反应的方程式____________, A处长导管的作用是冷凝回流,回流的主要物质有______________________(填化学式)实验结束后,向A中依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤,分液得粗溴苯,NaOH溶液洗涤的作用是____________;若进一步提纯粗产品,依次进行的实验操作名称是___________、__________。
(2)若小组同学欲在B 装置中用正丁醇、冰醋酸合成一种水果香精,则还需连接的装置是________(填序号),该装置中应加入试剂________。反应结束后,取下收集装置充分振荡后静置,分去水层,可得乙酸正丁酯粗产品。现要回收水层中的有机物,依次进行的实验操作名称及相关试剂为________、________、__________。
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是 ,其离子的原子结构示意图为
(2)元素的最高价氧化物对应的水化物中酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ;
(3)按要求写出下列两种物质的电子式:①的氢化物 ;⑨的最高价氧化物的对应的水化物 ;
(4)在以上元素的单质中,化学性质最不活泼的是 。