题目内容
【题目】孔雀石主要含Cu2(OH)2CO3 , 还含少量FeO、SiO2 . 以孔雀石为原料可制备CuSO45H2O步骤如下: 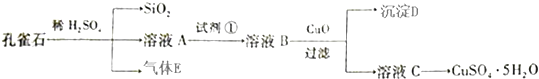
(1)写出孔雀石与稀硫酸反应的化学方程式: , 为了提高原料浸出速率,可采取的措施有(写出两条).
(2)溶液A的金属离子有Cu2+、Fe2+ . 实验步骤中试剂①最佳选(填代号)
a.KMnO4 b.Cl2 c.H2O2 d.HNO3
(3)溶液B中加入CuO作用是 .
(4)常温下Fe(OH)3的Ksp=1×10﹣39 , 若要将溶液中的Fe3+转化为Fe(OH)3沉淀,使溶液中c(Fe3+)降低至1×10﹣3mol/L,必需将溶液pH调节至 .
(5)由溶液C获得CuSO45H2O晶体,需要经、和过滤.
(6)可用KMnO4标准溶液测定溶液A中Fe2+的浓度,量取A溶液20.00ml,用0.010mol/L酸性KMnO4标准溶液滴定,消耗KMnO410.00ml,A溶液中Fe2+的物质的量浓度mol/L.
(反应原理:MnO4﹣+5Fe2++8H+═Mn2++5Fe3++4H2O)
【答案】
(1)Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O;增加硫酸浓度、将原料粉碎、提高反应温度,加催化剂等均可
(2)c
(3)调pH值,(或减少c(H+),)使Fe3+沉淀完全
(4)2
(5)蒸发浓缩(或加热蒸发、蒸发溶液);冷却结晶
(6)0.025
【解析】解:孔雀石主要含Cu2(OH)2CO3 , 还含少量Fe、Si的化合物,向孔雀石中加入足量稀硫酸,发生的反应有Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,Fe+H2SO4=FeSO4+H2↑,硅和稀硫酸不反应,溶液A只含Cu2+、Fe2+两种金属离子,然后过滤得到的滤渣中含有Si的氧化物,溶液A中含有含有铁盐和亚铁盐及硫酸铜,气体E为CO2、H2 , 向溶液A中加入试剂①得到溶液B,试剂①是一种氧化剂,将Fe2+转化为Fe3+且不能引进杂质,可选取双氧水,向溶液B中加入试剂②经过操作Ⅰ得到溶液C和红褐色沉淀D,则操作Ⅰ为过滤,D为Fe(OH)3 , 以及过量的试剂,溶液C为硫酸铜溶液,所以为试剂②为CuO或Cu(OH)2或CaCO3 或Cu2(OH)2CO3 , (1)碱式碳酸铜为碱式盐能与稀硫酸反应:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑,生成硫酸铜、水和二氧化碳,为了提高原料浸出速率,可采取的措施有增加硫酸浓度、将原料粉碎、提高反应温度,加催化剂等,所以答案是:Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;增加硫酸浓度、将原料粉碎、提高反应温度,加催化剂等;(2)Fe2+具有还原性,可被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,与KSCN不反应,加入氢氧化钠溶液可生成氢氧化铁、氢氧化铜沉淀而不能检验Fe2+ , 双氧水,双氧水是一种绿色试剂,将Fe2+氧化为Fe3+ , 但无明显现象,只有b正确,所以答案是:c;(3)在溶液B中加CuO调节溶液的pH使Fe3+完全沉淀,且不引入新的杂质,所以答案是:调pH值,(或减少c(H+),)使Fe3+沉淀完全;(4)常温下Fe(OH)3的Ksp=1×10﹣39 , 使溶液中c(Fe3+)=1×10﹣3mol/L,则c(OH﹣)= ![]() mol/L=1×10﹣12mol/L,所以溶液中c(H+)=1×10﹣2mol/L,则pH=2,所以答案是:2;(5)CuSO45H2O晶体,在高温时易失去水,所以从溶液中获得CuSO45H2O晶体,需要经蒸发浓缩(或加热蒸发、蒸发溶液),冷却结晶、过滤,所以答案是:蒸发浓缩(或加热蒸发、蒸发溶液);冷却结晶;(6)Fe2+溶液与KMnO4溶液发生氧化还原反应,反应中MnO4﹣被还原为Mn2+ , 最小公倍数为5,所以KMnO4前系数为1,Fe2+前系数为5,反应的离子方程式为MnO4﹣+5Fe2++8H+=Mn2++5Fe3++4H2O,根据离子方程可知MnO4﹣~5Fe2+ , 用去 KMnO4的物质的量为10.00mL×0.010mol/L=1.0×10﹣4mol,所以A溶液中Fe2+浓度为
mol/L=1×10﹣12mol/L,所以溶液中c(H+)=1×10﹣2mol/L,则pH=2,所以答案是:2;(5)CuSO45H2O晶体,在高温时易失去水,所以从溶液中获得CuSO45H2O晶体,需要经蒸发浓缩(或加热蒸发、蒸发溶液),冷却结晶、过滤,所以答案是:蒸发浓缩(或加热蒸发、蒸发溶液);冷却结晶;(6)Fe2+溶液与KMnO4溶液发生氧化还原反应,反应中MnO4﹣被还原为Mn2+ , 最小公倍数为5,所以KMnO4前系数为1,Fe2+前系数为5,反应的离子方程式为MnO4﹣+5Fe2++8H+=Mn2++5Fe3++4H2O,根据离子方程可知MnO4﹣~5Fe2+ , 用去 KMnO4的物质的量为10.00mL×0.010mol/L=1.0×10﹣4mol,所以A溶液中Fe2+浓度为 ![]() =0.025mol/L,所以答案是:0.025.
=0.025mol/L,所以答案是:0.025.

 快捷英语周周练系列答案
快捷英语周周练系列答案


