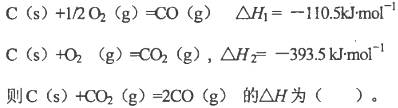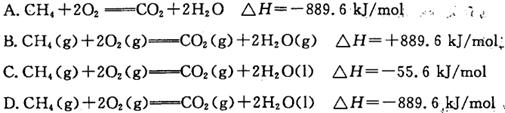题目内容
已知:NH3·H2O(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1;强酸、强碱的稀溶液反应的中和热为ΔH=-57.3 kJ·mol-1。则NH3·H2O在水溶液中电离的ΔH等于( )
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+69.4 kJ·mol-1 | D.+45.2 kJ·mol-1 |
D
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
近年来,全球气候变暖给人类的生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视。下列有关说法不正确的是( )
| A.太阳能、地热能、生物质能和核聚变能均属于“新能源” |
| B.“低碳”是指采用含碳量低的烃类作为燃料 |
C.下图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想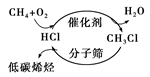 |
| D.让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用 |
甲醛是一种重要的化工产品,可以利用甲醇脱氢制备,反应式如下:
①CH3OH(g) CH2O(g)+H2(g) ΔH1="+84.2" kJ·mol-1
CH2O(g)+H2(g) ΔH1="+84.2" kJ·mol-1
向反应体系中通入氧气,通过反应②2H2(g)+O2(g) 2H2O(g) ΔH2="-483.6" kJ·mol-1提供反应①所需热量,要使反应温度维持在700 ℃,则进料中甲醇与氧气的物质的量之比约为( )
2H2O(g) ΔH2="-483.6" kJ·mol-1提供反应①所需热量,要使反应温度维持在700 ℃,则进料中甲醇与氧气的物质的量之比约为( )
| A.5.74∶1 | B.11.48∶1 | C.1∶1 | D.2∶1 |
已知:①2H2(g)+O2(g) 2H2O(g)ΔH="-483.6" kJ/mol
2H2O(g)ΔH="-483.6" kJ/mol
②H2(g)+S(g)=H2S(g) ΔH="-20.1" kJ/mol。下列判断正确的是( )
| A.1 mol氢气完全燃烧吸热241.8 kJ |
| B.1 mol H2O(g)和1 mol H2S(g)的能量相差221.7 kJ |
| C.由①②知,水的热稳定性小于硫化氢 |
| D.若反应②中改用固态硫,1 mol S(s)完全反应,放出的热量小于20.1 kJ |
某反应的ΔH=+100 kJ·mol-1,下列有关该反应的叙述正确的是( )
| A.正反应活化能小于100 kJ·mol-1 |
| B.逆反应活化能一定小于100 kJ·mol-1 |
| C.正反应活化能不小于100 kJ·mol-1 |
| D.正反应活化能比逆反应活化能大100 kJ·mol-1 |
已知:
S(s)+O2(g) SO2(g) ΔH=-297.16 kJ·mol-1,
SO2(g) ΔH=-297.16 kJ·mol-1,
2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1。
2SO3(g) ΔH=-196.6 kJ·mol-1。
下列说法正确的是 ( )
| A.1 mol SO2(g)的能量总和大于1 mol S(s)和1 mol O2(g)的能量总和 |
| B.将2 mol SO2(g)与1 mol O2(g)在一定条件下充分反应,放出196.6 kJ的热量 |
| C.S(g)+O2(g)=SO2(g) ΔH=-Q,Q值小于297.16 kJ |
| D.当1 mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46 kJ的热量 |
在25 ℃、101 kPa时,CH4(g)、H2(g)、C(s)的燃烧热分别是-890.3 kJ·mol-1、-285.8 kJ·mol-1和-393.5 kJ·mol-1,则CH4(g)―→C(s)+2H2(g)的ΔH是( )
| A.-74.8 kJ·mol-1 | B.+74.8 kJ·mol-1 |
| C.-211.0 kJ·mol-1 | D.+211.0 kJ·mol-1 |