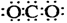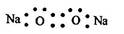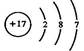题目内容
取一定量的KClO3和MnO2的混合物共热制取O2,反应开始时MnO2在混合物中的质量分数为20%,当反应进行到MnO2在混合物中的质量分数为25%时,求KClO3的分解百分率。
64%
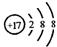
MnO2在反应中作催化剂,反应前后质量守恒。设原混合物的质量为m1g,反应结束后混合物的质量为m2g,则MnO2反应前后的质量分别为:0.2m1g和0.25m2g。由MnO2的质量守恒可得:0.2m1g=0.25m2g,m2=0.8m1。由反应前后质量守恒可知,放出O2的质量应等于反应前后的固体质量之差,即:m1g-m2g=m1g-0.8m1g=0.2m1g。即可求得KClO3的分解百分率为: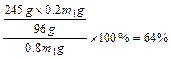

练习册系列答案
相关题目

 2K↑+ 3CO↑,
2K↑+ 3CO↑, CaF2 + 2K↑+ 2C。下列有关说法合理的是
CaF2 + 2K↑+ 2C。下列有关说法合理的是