题目内容
室温下,下列说法正确的是( )
| A、将pH=2的盐酸和pH=4的硫酸等体积混合,所得溶液pH=3 | ||
| B、HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH大 | ||
C、向0.1 mol/L氨水中加入少量硫酸铵固体,溶液中
| ||
| D、将1 mL pH=3的HA溶液稀释到10 mL,若溶液的pH<4,则HA为弱酸 |
分析:A.首先计算混合溶液中的c(H+),根据pH=lg[c(H+)计算];
B.根据越弱越水解的原则判断;
C.向0.1 mol/L氨水中加入少量硫酸铵固体,平衡NH3?H2O?NH4++OH-,结合盐类的水解的平衡移动的因素分析;
D.加水促进弱酸的电离.
B.根据越弱越水解的原则判断;
C.向0.1 mol/L氨水中加入少量硫酸铵固体,平衡NH3?H2O?NH4++OH-,结合盐类的水解的平衡移动的因素分析;
D.加水促进弱酸的电离.
解答:解:A.混合后c(H+)=
mol/L≈
×10-2mol/L,pH=2.3,故A错误;
B.根据越弱越水解的原则,HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH小,故B错误;
C.氨水中存在NH3?H2O?NH4++OH-,加入少量硫酸铵固体,平衡向逆方向移动,则溶液中
减小,故C错误;
D.将1 mL pH=3的HA溶液稀释到10 mL,如pH=4,则HA为强酸,如pH<4,加水促进弱酸的电离,则HA为弱酸,故D正确.
故选D.
| 10-2+10-4 |
| 2 |
| 1 |
| 2 |
B.根据越弱越水解的原则,HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH小,故B错误;
C.氨水中存在NH3?H2O?NH4++OH-,加入少量硫酸铵固体,平衡向逆方向移动,则溶液中
| c(OH-) |
| c(NH3?H2O) |
D.将1 mL pH=3的HA溶液稀释到10 mL,如pH=4,则HA为强酸,如pH<4,加水促进弱酸的电离,则HA为弱酸,故D正确.
故选D.
点评:本题考查较为综合,涉及pH的计算、盐类的水解以及弱电解质的电离等知识,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
室温下,下列说法正确的是( )
| A、将pH=1的H2SO4和pH=3的HCl等体积混合,所得溶液pH=2 | ||
| B、HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH大 | ||
C、向0.1mol/L CH3COOH溶液中加入少量CH3COONa固体,溶液中
| ||
| D、将1mL pH=3的HX溶液稀释到10mL,若溶液的pH<4,则HX为弱酸 |
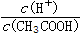 增大
增大