题目内容
常温下,下列有关电解质溶液的说法中正确的是( )
| A、pH为2的醋酸,水电离出的c(H+)=1×10-2mol/L |
| B、0.1mol?L-1的H2SO4溶液与0.1mol?L-1的NaOH溶液等体积混合,溶液呈中性 |
| C、饱和醋酸钠溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) |
| D、从Cu2+(aq)+MnS(s)?CuS(s)+Mn2+(aq)方程式中得出CuS的溶度积比MnS的溶度积大 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A、pH为2的醋酸,c(H+)=10-2mol/L,c(OH-)=10-12mol/L,氢氧根是由水电离出来的,水电离出的氢离子和氢氧根离子浓度相等;
B、0.1mol?L-1的H2SO4溶液与0.1mol?L-1的NaOH溶液等体积混合,酸过量,溶液呈酸性;
C、物料守恒,得c(Na+)=c(CH3COO-)+c(CH3COOH);
D、类型相同,向生成浓度小的方向移动.
B、0.1mol?L-1的H2SO4溶液与0.1mol?L-1的NaOH溶液等体积混合,酸过量,溶液呈酸性;
C、物料守恒,得c(Na+)=c(CH3COO-)+c(CH3COOH);
D、类型相同,向生成浓度小的方向移动.
解答:
解:A、pH为2的醋酸,c(H+)=10-2mol/L,c(OH-)=10-12mol/L,氢氧根是由水电离出来的,水电离出的氢离子和氢氧根离子浓度相等,故A错误;
B、0.1mol?L-1的H2SO4溶液与0.1mol?L-1的NaOH溶液等体积混合,酸过量,溶液呈酸性,故B错误;
C、物料守恒,得c(Na+)=c(CH3COO-)+c(CH3COOH),故C正确;
D、类型相同,向生成浓度小的方向移动,CuS的溶度积比MnS的溶度积小,故D错误;
故选C.
B、0.1mol?L-1的H2SO4溶液与0.1mol?L-1的NaOH溶液等体积混合,酸过量,溶液呈酸性,故B错误;
C、物料守恒,得c(Na+)=c(CH3COO-)+c(CH3COOH),故C正确;
D、类型相同,向生成浓度小的方向移动,CuS的溶度积比MnS的溶度积小,故D错误;
故选C.
点评:本题考查弱电解质的电离,根据水电离特点、难溶电解质的溶解平衡原理、物料守恒来分析解答即可,难度中等.

练习册系列答案
相关题目
代表有机物中几种同系物的相对分子质量的一组数字是( )
| A、16、32、48、64 |
| B、2、16、30、44、58 |
| C、16、17、18、19 |
| D、46、60、74、88、102 |
下列各组含氧酸中,酸性依次增强的是( )
| A、H2CO3、H4SiO4、H3PO4 |
| B、HNO3、H3PO4、H2SO4 |
| C、H3PO4、H2SO4、HClO4 |
| D、HClO4、H2SO4、H2CO3 |
下列关于胶体的性质叙述正确的是( )
| A、只带正电荷 |
| B、能产生丁达尔效应 |
| C、相当稳定 |
| D、都是透明的 |
下列各项叙述中,正确的是( )
| A、C6H5CH2CH2OH与C6H5OH互为同系物 |
| B、H2O与D2O互为同素异形体 |
C、 与 与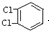 互为同分异构体 互为同分异构体 |
| D、等物质的量的乙醇和乙烯完全燃烧时所需氧气的质量相等 |
在1s、2px、2py、2pz轨道中,具有球对称性的是( )
| A、1s |
| B、2px |
| C、2py |
| D、2pz |
下列关于离子键的说法中,正确的是( )
| A、阴阳离子间相互吸引即离子键 |
| B、非金属元素所组成的化合物中不可能有离子键 |
| C、一个阳离子只可与一个阴离子之间存在离子键 |
| D、活泼金属与非金属化合时一般形成离子键 |
下列说法正确的是( )
| A、元素的种类由核外电子数决定 |
| B、核外电子排布相同的两个微粒一定是同种原子 |
| C、原子的种类由原子核内质子数与中子数共同决定 |
| D、某元素的原子核内有m个质子,n个中子,则该元素的相对原子质量为m+n |
下列叙述正确的是( )
| A、Na2CO3溶液:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) |
| B、某二元酸(用H2A表示)在水中的电离方程式是:H2A═H++HA-,HA-?H++A2-则NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
| C、常温下,pH=12的氨水溶液与pH=2的盐酸溶液等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、常温下,10mL pH=12的Ba(OH)2溶液与40mL c mol?L-1的NaHSO4溶液混合,当溶液中的Ba2+、SO42-均恰好完全沉淀,若混合后溶液的体积为50mL,则溶液pH=11 |