题目内容
最近中国科学院上海高等研究院在合成气直接制烯烃研究获重大突破。已知:
反应①:C(s)+1/2O2(g)=CO(g) △H1
反应②:C(s)+H2O(g)=CO(g)+H2(g) △H2
反应③:CO(g)+2H2(g)=CH3OH(g) △H3=-90.1kJ·mol-1
反应④:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=-134.0kJ·mol-1
反应⑤:3CH3OH(g)=CH3CH=CH2(g)+3H2O(g) △H5=-31.0kJ·mol-1
下列说法正确的是
A.△H1-△H2<0
B.反应②为放热反应
C.3CH3OCH3(g)=2CH3CH=CH2(g)+3H2O(g) △H=-103.0kJ·mol-1
D.3CO(g)+6H2(g)=CH3CH=CH2(g)+3H2O(g) △H=-301.3kJ·mol-1
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
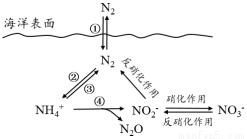
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是 (填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是 (填字母序号)。
a. 海洋中的氮循环起始于氮的氧化
b. 海洋中存在游离态的氮
c. 向海洋排放含NO3-的废水会影响海洋中NH4+的含量
d. 海洋中的反硝化作用一定有氧气的参与
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将离子方程式补充完整:
 NH4++5O2
NH4++5O2 2NO2-+
2NO2-+ H++
H++ +
+
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:
温度/℃ | 样本氨氮含量/mg | 处理24 h | 处理48 h |
氨氮含量/mg | 氨氮含量/mg | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
硝化细菌去除氨氮的最佳反应温度是 ,在最佳反应温度时,48 h内去除氨氮反应的平均速率是 mg·L-1·h-1。
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。如图是间接氧化工业废水中氨氮(NH4+)的示意图。
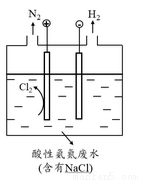
结合电极反应式简述间接氧化法去除氨氮的原理: 。
若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将 (填“增大”、“不变”或“减小”),请简述理由: 。


 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75 NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75 NA  2Cu+
2Cu+