题目内容
(6分)用VSEPR 理论判断:
| 物质 | 孤对电子对数 | 轨道杂化形式 | 分子或离子的形状 |
| NH4+ | | | |
| NCl3 | | | |
(6分)用VSEPR理论判断:(各1分)
| 物质 | 孤对电子对数 | 轨道杂化形式 | 分子或离子的形状 |
| NH4+ | 0 | Sp3 | 正四面体 |
| NCl3 | 1 | Sp3 | 三角锥形 |
由公式:孤对电子对数=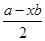 可求得NH4+为0、NCl3为1,价层电子对数分别为4、3,则轨道杂化形式均为Sp3,但微粒形状分别为正四面体和三角锥形。
可求得NH4+为0、NCl3为1,价层电子对数分别为4、3,则轨道杂化形式均为Sp3,但微粒形状分别为正四面体和三角锥形。
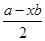 可求得NH4+为0、NCl3为1,价层电子对数分别为4、3,则轨道杂化形式均为Sp3,但微粒形状分别为正四面体和三角锥形。
可求得NH4+为0、NCl3为1,价层电子对数分别为4、3,则轨道杂化形式均为Sp3,但微粒形状分别为正四面体和三角锥形。
练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
