题目内容
20.用草酸的稀溶液或草酸钠的酸性溶液可以洗涤粘在皮肤上的高锰酸钾,其离子方程式为(未配平):MnO${\;}_{4}^{-}$+C2O${\;}_{4}^{2-}$+H+-→CO2↑+Mn2++.关于此反应的叙述正确的是( )| A. | 该反应右边方框内的产物是OH- | B. | 配平该反应后,H+的化学计量数是8 | ||
| C. | 该反应中氧化产物是CO2 | D. | 该反应电子转移总数是5e- |
分析 A.酸性条件下,不可能生成OH-,含有H元素,应生成H2O;
B.反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,H2C2O4→CO2,碳元素化合价由+3价升高为+4价,共升高2价,化合价升降最小公倍数为10,据此结合电荷守恒、原子守恒配平方程式;
C.所含元素化合价升高的反应物是还原剂,还原剂发生氧化反应生成氧化产物;
D.根据配平后的方程式解答.
解答 解:A.酸性条件下,不可能生成OH-,含有H元素,应生成H2O,故A错误;
B.反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,H2C2O4→CO2,碳元素化合价由+3价升高为+4价,共升高2价,化合价升降最小公倍数为10,结合电荷守恒、原子守恒配平方程式为:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O,H+的计量数是6,故B错误;
C.反应中H2C2O4→CO2,碳元素化合价由+3价升高为+4价,H2C2O4是还原剂,发生氧化反应生成CO2,CO2是氧化产物,故C正确;
D.由B可知配平方程式为:2MnO4-+5H2C2O4+6H+═10CO2↑+2Mn2++8H2O,转移电子数为10,故D错误;
故选C.
点评 本题考查氧化还原反应配平、基本概念等,确定缺项物质是关键,要求学生具有分析和解决问题的能力,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.含H-的化合物跟氨反应:H-+NH3═NH${\;}_{2}^{-}$+H2.根据该反应事实,可以得出的正确结论是( )
| A. | NH3具有还原性 | B. | 含H-的化合物是强氧化剂 | ||
| C. | H2既是氧化产物又是还原产物 | D. | 该反应属于置换反应 |
15.某烃1mol最多能和2mol HCl加成,生成氯代烃,此氯代烃l mol能和4mol Cl2发生完全取代反应,此烃为( )
| A. | C2H2 | B. | C2H4 | C. | C3H4 | D. | C6H6 |
5.下列关于化学反应的说法中正确的是( )
| A. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 相同温度下,H2(g)+CO2(g)?CO(g)+H2O(g)中,密闭容器中两种反应物浓度为0.020 mol/L的反应速率大于两种反应物浓度为0.010 mol/L的反应速率 |
10.2molC在一定量的O2中充分燃烧,生成CO、CO2,其中CO的物质的量为1mol,求共消耗O2的质量为( )
| A. | 32g | B. | 48g | C. | 16g | D. | 64g |
 有如下有机物:(每空一分)
有如下有机物:(每空一分) ②
②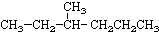 ③
③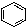 ④CH3CH=CHCH3 ⑤
④CH3CH=CHCH3 ⑤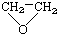 ⑥
⑥ ⑦
⑦
 ,其分子中碳原子sp3杂化.
,其分子中碳原子sp3杂化.