题目内容
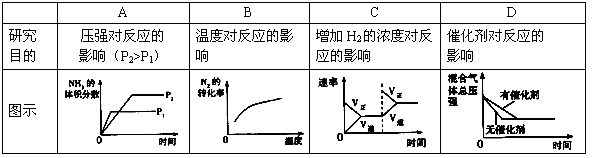
对于可逆反应N2(g)+3H2(g)  2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是
【答案】
C
【解析】
试题分析:A、该反应中增大压强平衡向正反应方向移动,则氨气的体积分数增大,并且压强越大,化学反应速率越大,达到化学平衡的时间越少,与图象不符,故A错误;B、因该反应是放热反应,升高温度化学平衡向逆反应反应移动,则氮气的转化率降低,与图象中转化率增大不符,故B错误;C、反应平衡后,增大氮气的量,则这一瞬间正反应速率增大,逆反应速率不变,然后正反应速率在不断减小,逆反应速率不断增大,直到新的平衡,与图象符合,故C正确;D、因催化剂对化学平衡无影响,但催化剂加快化学反应速率,则有催化剂时达到化学平衡的时间少,与图象不符,故D错误。
考点:化学平衡的影响因素;产物百分含量与压强的关系曲线;转化率随温、压强的变化曲线;化学反应速率与化学平衡图象的综合应用。

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
对于可逆反应N2(g)+3H2(g)![]() 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |
|
|
|
|
对于可逆反应N2(g)+3H2(g) 2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
| A.v(H2)=0.005 mol/(L·s) | B.v(NH3)=0.01 mol/(L·s) |
| C.v(N2)=0.2 mol/(L·min) | D.v(H2)=0.4 mol/(L·min) |




 2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是