题目内容
(8分)氯碱工业上通过电解饱和食盐水可得到氯气和氢气。已知100g 23.4%的饱和食盐水完全电解,问:
(1)生成氯气多少克?
(2)这些氯气中所含的分子数为多少?
(3)这些氯气在标准状况下的体积是多少升?
(4)若反应后溶液的总体积为100ml,则所得NaOH溶液的物质的量浓度是多少mol.L-1?
(1)生成氯气多少克?
(2)这些氯气中所含的分子数为多少?
(3)这些氯气在标准状况下的体积是多少升?
(4)若反应后溶液的总体积为100ml,则所得NaOH溶液的物质的量浓度是多少mol.L-1?
(1)14.2g(2)1.204×1023(3)4.48L(4)4.0 mol.L-1
试题分析:(1)100g 23.4%的饱和食盐中溶质的质量是100g×0.234=23.4g,物质的量是23.4g÷58.5g/mol=0.4mol。根据反应的方程式2NaCl+2H2O
 2NaOH+H2↑+Cl2↑可知,生成氯气的物质的量是0.4mol÷2=0.2mol,质量是0.2mol×71g/mol=14.2g。
2NaOH+H2↑+Cl2↑可知,生成氯气的物质的量是0.4mol÷2=0.2mol,质量是0.2mol×71g/mol=14.2g。(2)根据
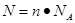 可知,氯气分子数是0.2mol×6.02×1023/mol=1.204×1023。
可知,氯气分子数是0.2mol×6.02×1023/mol=1.204×1023。(3)根据
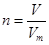 可知,氯气在标准状况下的体积是0.2mol×22.4L/mol=4.48L。
可知,氯气在标准状况下的体积是0.2mol×22.4L/mol=4.48L。(4)生成氢氧化钠的物质的量是0.4mol,所以浓度是0.4mol÷0.1L=4.0mol/L。
点评:在进行物质的量的有关计算时,关键是熟练应用几个关系式
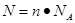 、n=m/M、
、n=m/M、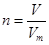 、
、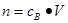 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。另外根据方程式进行的有关计算,关键是准确写出反应的方程式,然后找出已知量和未知量之间的关系,列式计算即可。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。另外根据方程式进行的有关计算,关键是准确写出反应的方程式,然后找出已知量和未知量之间的关系,列式计算即可。
练习册系列答案
相关题目
 )最大的是( )
)最大的是( ) 的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为()
的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为()