题目内容
7.一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量为0.8mol.下列判断正确的是( )| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2min后,加压会使正反应速率增大,逆反应速率减小,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 该条件下此反应的化学平衡常数的数值约为0.91 |
分析 A、反应前后气体质量和气体体积发生变化,若混合气体的密度不再改变时,该反应一定达到平衡状态;
B、2min后,加压会使正、逆反应速率都加快,平衡正向移动;
C、将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,反应比和起始量之比相同,所以反应过程中A和B的转化率相同;
D、由图象中的数据,平衡后D生成物质的量为0.8mol,结合化学三段式列式
3A(g)+B(g)?C(g)+2D(s)
起始量(mol) 3 1 0 0
变化量(mol) 1.2 0.4 0.4 0.8
平衡量(mol) 1.8 0.6 0.4 0.8
平衡浓度为c(A)=0.9mol/L,c(B)=0.3mol/L,c(C)=0.2mol/L,D为固体不写入平衡常数计算式.
解答 解:A、反应生成固体D,气体质量和气体体积发生变化,若混合气体的密度不再改变时,该反应一定达到平衡状态,故A错误;
B、2min后,加压会使正、逆反应速率都加快,平衡正向移动,故B错误;
C、将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,反应比和起始量之比相同,所以反应过程中A和B的转化率之比为1:1,故C错误;
D、由图象中的数据,平衡后D生成物质的量为0.8mol,结合化学三段式列式
3A(g)+B(g)?C(g)+2D(s)
起始量(mol) 3 1 0 0
变化量(mol) 1.2 0.4 0.4 0.8
平衡量(mol) 1.8 0.6 0.4 0.8
平衡浓度为c(A)=0.9mol/L,c(B)=0.3mol/L,c(C)=0.2mol/L,D为固体可计算得此反应的化学平衡常数=$\frac{0.2}{0.{9}^{3}×0.3}$=0.91,平衡常数约为0.91,故D正确.
故选:D.
点评 本题考查了化学平衡标志分析,平衡常数概念的计算应用,主要是一些反应速率、化学平衡的因素分析判断,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 使用聚二氧化碳塑料会产生白色污染 | |
| B. | 聚二氧化碳塑料是通过聚合反应制得的 | |
| C. | 聚二氧化碳塑料与干冰互为同分异构体 | |
| D. | 聚二氧化碳塑干冰都属于纯净物 |
| A. | 铜 | B. | 硝酸钾 | C. | 氢氧化钠 | D. | 纯醋酸 |
| A. | 洗涤沉淀的方法是直接向过滤器中加入适量蒸馏水,然后让水自然流下 | |
| B. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| C. | 用100ml量筒量取9.5 mL的液体 | |
| D. | 焰色反应中,观察焰色后应趁热将铂丝插入到稀硫酸中,然后再次灼烧 |
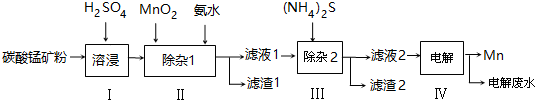
已知25℃,部分物质的溶度积常数如表:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)则滤渣1的主要成分为Fe(OH)3(填化学式).已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+.
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失.
(4)滤液2中,c(Co2+):c(Ni2+)=5:1.
(5)将质量为a kg的碳酸锰矿经上述流程处理后得到单质Mn b kg.若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为$\frac{(b-\frac{c}{107}×\frac{1}{2}×55)×\frac{115}{55}}{a}$×100%.(用含a、b、c的式子表达,无需化简)
 按要求填空:
按要求填空: