题目内容
已经知25℃时几种物质的电离度(溶液浓度为0.1mol)如下表:
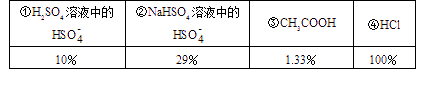
(已知(H2SO4的第一步是完全电离的)
(1)25℃时,0.1mol/L上述几种溶液[H+]由大到小的顺序是(填序号)____;
(2)25℃时,pH值相同的上述几种溶液,其物质的量浓度由大到小的顺序是____;
(3)25℃时,将足量的 Zn粉放入等体积、pH=1的上述几种溶液中产生氢气的体积(同温同压下),由大到小顺序为____;
![]()
![]()
(1)①④②③
(2)③②④①
(3)③②①④
(4)HSO4-![]() H++SO42-,H2SO4第一步电离产生的 H+能使HSO4-的电离平衡向左移动,抑制了HSO4-的电离,而NaHSO4中的HSO4-则无这种作用,因此其电离度大。</PGN0067A.TXT/PGN>
H++SO42-,H2SO4第一步电离产生的 H+能使HSO4-的电离平衡向左移动,抑制了HSO4-的电离,而NaHSO4中的HSO4-则无这种作用,因此其电离度大。</PGN0067A.TXT/PGN>
解析:
(1)对上述四种溶液,均为0.1mol/L时,H2SO4=H++HSO4-,HSO4-![]() H++SO42-,所以其[H+]=0.1+0.1×10%=0.11(mol/L),NaHSO4中的[H+]=0.1×0.29=0.029mol/L,CH3COOH中的[H+]=0.1×0.0133=1.33×10-3mol/L而HCl中的[H+]=0.1×100%= 0.1mol/L
H++SO42-,所以其[H+]=0.1+0.1×10%=0.11(mol/L),NaHSO4中的[H+]=0.1×0.29=0.029mol/L,CH3COOH中的[H+]=0.1×0.0133=1.33×10-3mol/L而HCl中的[H+]=0.1×100%= 0.1mol/L
∴顺序为①④②③
(2)25℃,pH值相同的四种溶液,[H+]浓度相同,其电离度越小,该电解质溶液的浓度越大,所以应为:③②④①,其中H2SO4的浓度最小,是因为它的第一步完全电离与HCl相同,但其第二步又可电离出一定的H+,所以二者综合,其浓度最小。
(3)在等体积,[H+]浓度相同的情况下,加入足量的Zn粉,将产生氢气的量与各电解质的浓度有关,因该反应可进行到底,溶液浓度越大,则溶质的物质的量越大,产生H2越多,但对H2SO4和HCl而言,其pH都为1,盐酸浓度要比H2SO4大;但反应中,盐酸完全消耗,而H2SO4为二元酸,第一步完全电离,第二步也在与Zn反应中趋于完全进行,所以[H+]浓度在反应中增加,产生的氢气量比盐酸多,顺序为③②①④。

(8分)已知25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
| ①硫酸溶液 | ②硫酸氢钠溶液 | ③醋酸溶液 | ④盐酸 |
| HSO4- | HSO4- | CH3COOH | HCl = H++Cl- |
| 10℅ | 29℅ | 1.33℅ | 100℅ |
⑴根据题意,请写出向硫酸溶液中滴加足量氢氧化钡溶液反应的离子反应方程式
⑵25℃时,0.1mol/L上述几种溶液中C(H+)由大到小的顺序是 (填序号,下同);
⑶25℃时,将足量锌粉放入等体积pH=1的上述几种溶液中,产生H2的体积(相同状况)由大到小的顺序是 ;
⑷25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是:
(8分)已知25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
| ①硫酸溶液 | ②硫酸氢钠溶液 | ③醋酸溶液 | ④盐酸 |
HSO4- H++SO42— H++SO42— | HSO4- H++SO42- H++SO42- | CH3COOH CH3COO-+H+ CH3COO-+H+ | HCl = H++Cl- |
| 10℅ | 29℅ | 1.33℅ | 100℅ |
⑵25℃时,0.1mol/L上述几种溶液中C(H+)由大到小的顺序是 (填序号,下同);
⑶25℃时,将足量锌粉放入等体积pH=1的上述几种溶液中,产生H2的体积(相同状况)由大到小的顺序是 ;
⑷25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是:
(8分)已知25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
|
①硫酸溶液 |
②硫酸氢钠溶液 |
③醋酸溶液 |
④盐酸 |
|
HSO4- |
HSO4- |
CH3COOH |
HCl = H++Cl- |
|
10℅ |
29℅ |
1.33℅ |
100℅ |
⑴根据题意,请写出向硫酸溶液中滴加足量氢氧化钡溶液反应的离子反应方程式
⑵25℃时,0.1mol/L上述几种溶液中C(H+)由大到小的顺序是 (填序号,下同);
⑶25℃时,将足量锌粉放入等体积pH=1的上述几种溶液中,产生H2的体积(相同状况)由大到小的顺序是 ;
⑷25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是:
 H++SO42—
H++SO42—