题目内容
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等。甲的化学式为YX3,是一种刺激性气味的气体,乙是由X、Y、Z组成的盐。下列说法正确的是
| A.由X、Y、Z组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度小于酸根离子浓度 |
| B.YX3的水溶液呈弱碱性,能使湿润的蓝色石蕊试纸变红 |
| C.原子半径:Z<Y<W,而简单离子半径:W<Y<Z |
| D.W的氯化物熔点低,易升华,但水溶液能导电,由此推断它属于弱电解质 |
A
解析试题分析:甲的化学式为YX3,是一种刺激性气味的气体,由其化学式形式判断甲是氨气,X是H元素,Y是N元素;X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等。W有3层电子,最外层3个电子,所以W是Al元素,则Z是O元素。乙是硝酸铵。A、硝酸铵的水溶液呈酸性,因为铵根离子的水解使溶液显酸性同时铵根离子浓度小于硝酸根离子浓度,正确;B、YX3的水溶液呈弱碱性,能使湿润的红色石蕊试纸变蓝,错误;C、根据半径的比较原则,原子半径:Z<Y<W,而简单离子半径:W<Z<Y,错误;D、氯化铝熔点低,易升华,说明它是分子晶体,但水溶液能导电,不能推断它是弱电解质,错误,答案选A。
考点:考查元素推断,元素周期律的应用,化合物的性质

香花石被誉为“矿石熊猫”,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是:( )
| A.原子半径:Y>Z>R>T |
| B.气态氢化物的稳定性:W<R<T |
| C.最高价氧化物对应的水化物碱性:X>Z |
| D.XR2、WR2两化合物中R的化合价相同 |
下列顺序正确的是( )
| A.熔点:SiO2< NaF<KCl | B.水溶性:NH3<SO2<HCl |
| C.酸性:HF>HCl>HI | D.碱性:Mg(OH)2<KOH<RbOH |
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
| A.同一元素不可能既表现金属性,又表现非金属性 |
| B.第三周期主族元素的最高正化合价等于它所处的主族序数 |
| C.短周期元素形成离子后,最外层都达到8电子稳定结构 |
| D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | —— |
| 最低负价 | —— | -1 | —— | —— | -3 | -2 | |
A.元素X和Q形成的化合物中不可能含有共价键
B.X、Z、R的最高价氧化物的水化物之间可两两相互反应
C.R3-比Q2-更容易失去电子
D.M(OH)2的碱性比XOH的碱性强
在短周期元素中,A元素的最高正化合价和最低负化合价的绝对值之差为6,A元素与B元素可以形成化合物BA2,A的阴离子与B的阳离子具有相同的电子层结构,则该化合物是 ( )
| A.MgCl2 | B.CaCl2 | C.SiO2 | D.CS2 |
短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是 ( )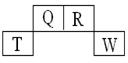
| A.H2R2的分子中既含有极性共价键,又含有非极性共价键 |
| B.Q、R的简单氢化物分子所含质子数、电子数与Ne分子相同 |
| C.T的氧化物是一种良好的半导体材料 |
| D.Q的氢化物与W的氢化物反应有白烟现象,且生成物中既含有离子键,又含有共价键 |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法正确的是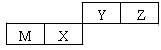
| A.原子半径Z > Y |
| B.X 的最简单气态氢化物的热稳定性比Z的小 |
| C.Y的最高价氧化物对应水化物的酸性比X 的弱 |
| D.M的最高价氧化物对应水化物不能与NaOH溶液反应 |