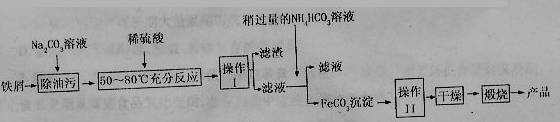
题目内容
将足量的铜屑加入到浓度均为2mol?L-1的HNO3和H2SO4的混合溶液100ml中,充分反应后,转移电子的物质的量为( )
| A、0.6 mol | B、0.8 mol | C、0.45 mol | D、0.4 mol |
分析:发生3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,铜足量,n(NO3-)=0.2mol,n(H+)=0.2mol+0.2mol×2=0.6mol,由反应可知,氢离子不足,以此计算.
解答:解:足量的铜屑加入到浓度均为2mol?L-1的HNO3和H2SO4的混合溶液100ml中,
铜足量,n(NO3-)=0.2mol,n(H+)=0.2mol+0.2mol×2=0.6mol,
由3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,氢离子不足,设转移电子为x,则
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O~6e-
8 6
0.6mol x
=
,解得x=0.45mol,
故选C.
铜足量,n(NO3-)=0.2mol,n(H+)=0.2mol+0.2mol×2=0.6mol,
由3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,氢离子不足,设转移电子为x,则
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O~6e-
8 6
0.6mol x
| 8 |
| 0.6mol |
| 6 |
| x |
故选C.
点评:本题考查氧化还原反应的计算,把握发生的氧化还原反应中其实质为离子反应,明确过量分析及转移的电子数即可解答,题目难度不大.

练习册系列答案
相关题目