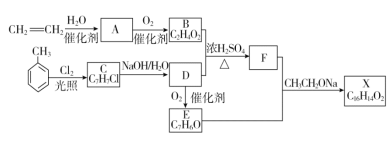
题目内容
【题目】由下列实验事实得出的结论正确的是( )
A.由SiO2不能与水反应生成H2SiO3,可知SiO2不是酸性氧化物
B.由SiO2+2C![]() Si+2CO↑,可知碳的非金属性大于硅
Si+2CO↑,可知碳的非金属性大于硅
C.CO2通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3
D.SiO2与NaOH溶液反应,也可与氢氟酸反应,则SiO2为两性氧化物
【答案】C
【解析】
A.二氧化硅能与氢氧化钠溶液反应生成硅酸钠和水,二氧化硅属于酸性氧化物,A错误;
B.该反应中,碳是还原剂,硅是还原产物,只能说明高温下碳的还原性强于硅,但是不能证明碳的非金属性大于硅,B错误;
C.CO2通入Na2SiO3溶液产生白色沉淀,说明反应生成难溶于水的硅酸,可以证明碳酸的酸性强于硅酸,C正确;
D.二氧化硅只能溶于特殊的氢氟酸,不能溶于其他强酸,且反应SiO2+4HF=SiF4↑+2H2O中SiF4不属于盐类,故二氧化硅不属于两性氧化物,D错误;
答案选C。

【题目】氨是重要的基础化工原料,可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)、尿素[CO(NH2)2]等多种含氮的化工产品。
(1)水能发生自偶电离2H2O![]() H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程式_______。
H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程式_______。
(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
化学式 | HNO2 | H2N2O2 |
电离常数 | Ka=5.1×10-4 | Ka1=6.17×10-8、Ka2=2.88×10-12 |
①物质的量浓度相同的NaNO2和NaHN2O2溶液的pH(NaNO2)_____pH(NaHN2O2)(填“>”、“<”或“=”)。
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=_______(保留三位有效数字)。
③0.lmol/LNa2N2O2溶液中离子浓度由大到小的顺序为____________。
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) △H1=-159.5kJmol-1;
NH2CO2NH4(s) △H1=-159.5kJmol-1;
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1;
CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1;
反应III:H2O(l)═H2O(g) △H3=+44.0kJmol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为____________。
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g,容器内的压强p随时间t的变化如图1所示。
①T1℃时,该反应的平衡常数K的值为___________。
②图2中能正确反应平衡常数K随温度变化关系的曲线为__________(填字母标号)。

(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图3所示。则b电极上的电极反应式为______________。