题目内容
将
(1)写出OA段所发生反应的离子方程式____________________________。
(2)当加入35 mL硫酸溶液时,产生二氧化碳的体积(标准状况)是______________mL。
(3)若硫酸溶液用量达到上图B点时,经测定溶液中c(Na+)为1 mol·L-1,则溶液中c(![]() )为______________(设溶液体积的变化忽略不计)。
)为______________(设溶液体积的变化忽略不计)。
(4)原混合物中氢氧化钠的质量分数为____________________________。
解析:解答本题应该先明确A、B两点代表的意义。A点以前加入的硫酸没有产生CO2,这说明加入的硫酸只是把溶液中的![]() 转变成了
转变成了![]() ,该点恰好完全转化;B点开始,再加入硫酸不会产生CO2,说明
,该点恰好完全转化;B点开始,再加入硫酸不会产生CO2,说明![]() 已经全部与硫酸反应生成了CO2和水,该点恰好完全反应。根据
已经全部与硫酸反应生成了CO2和水,该点恰好完全反应。根据![]() +H+
+H+![]()
![]()
![]() +H+
+H+![]() CO2↑+H2O,如果碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水后,溶液中仅有碳酸钠的话,以上两个反应消耗硫酸相等,从图看,到A点消耗硫酸的量大于A到B消耗的量,说明溶液中还存在H++OH-
CO2↑+H2O,如果碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水后,溶液中仅有碳酸钠的话,以上两个反应消耗硫酸相等,从图看,到A点消耗硫酸的量大于A到B消耗的量,说明溶液中还存在H++OH-![]() H2O的反应,存在氢氧化钠,有5 mL的硫酸中和溶液中的氢氧化钠;有20 mL硫酸将溶液中的碳酸钠转化成碳酸氢钠。溶液中的碳酸钠来源于固体中的碳酸钠以及固体中的氢氧化钠和固体碳酸氢钠在溶液中相互反应产生的碳酸钠。根据
H2O的反应,存在氢氧化钠,有5 mL的硫酸中和溶液中的氢氧化钠;有20 mL硫酸将溶液中的碳酸钠转化成碳酸氢钠。溶液中的碳酸钠来源于固体中的碳酸钠以及固体中的氢氧化钠和固体碳酸氢钠在溶液中相互反应产生的碳酸钠。根据![]() +OH-
+OH-![]()
![]() +H2O,固体氢氧化钠的物质的量应该等于固体中碳酸氢钠的物质的量加上5 mL的硫酸中和溶液中氢氧化钠的物质的量,再根据三者质量和为
+H2O,固体氢氧化钠的物质的量应该等于固体中碳酸氢钠的物质的量加上5 mL的硫酸中和溶液中氢氧化钠的物质的量,再根据三者质量和为
答案:(1)H++OH-![]() H2O
H2O
![]() +H+
+H+![]()
![]()
(2)448
(3)0.5 mol·L-1
(4)24.0%

实验步骤:
①将2cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净.
②在细口瓶中加入30mL1.0mol/L的H3PO4、3mL30%的H2O2溶液,将处理后的铁丝放入其中.
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时.
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证.
甲同学认为是H2,其可能的理由是:
乙同学认为是O2,其可能的理由是:
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a) Fe+2H+→Fe2++H2 (b)2Fe2++H2O2+H2O→Fe2O3+4H+
(c)Fe2O3+6H+→2Fe3++3H2O (d)2Fe3++H2→2Fe2++2H+,依据过程:
(a)→(b)→(c)→(d)→(a)…周而复始.
依据此机理,四步反应总的反应方程式为:
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
| ① | ② | ③ | |
| 硫酸溶液体积/mL | 50 | 50 | 50 |
| 称取铁钉质量/g | 5.0 | 6.0 | 7.0 |
| 再投入铜粉质量/g | 1.0 | 1.0 | 1.0 |
| 标准状况下的体积/L | 1.97 | 2.24 | 2.24 |
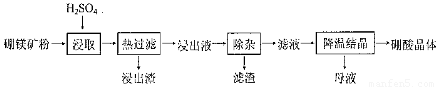
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2Mg0.B203.H20、 Si02及少量Fe304、CaCO3, Al2O3)为原料生产硼酸的工艺流程如下:
已知:H3BO3在200C、400C、600C、1000C时的溶解度依次为5.0 g、8.7 g、14.8 g、 40. 2 g。Fe3 +、Al3 +、Fe2 +和Mg2 +以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、 5.2、9.7和 12.4。
(1)由于矿粉中含CaC03,为防止“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施是: ??????????????????????????????????????????????????????????????????????????????????? 。
(2)“浸出液”显酸性,含H3B03和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H202和Mg0,除去的杂质离子是_______。H2O2的作用是____________________________________________ (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是_____________________________________。
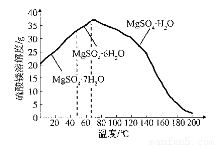
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶 液的沸点随压强增大而升高。为了从“母液”中充分回收MgS04·H20,应采取的 措施是将“母液”蒸发浓缩,____________
(5)硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  [B(OH)4]-(aq)+H+(aq)?? K=5.7×10-10(298K)
[B(OH)4]-(aq)+H+(aq)?? K=5.7×10-10(298K)
计算25℃时0.7mol·L-1 硼酸溶液中H+的浓度。(写出计算过程)
(6)已知298K时:
化学式 | 碳酸 | 醋酸 |
电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是??????????????? 。
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸中能观察到有气泡产生
C.等浓度的碳酸和硼酸溶液比较,pH:前者>后者
D.等浓度的碳酸钠和醋酸钠溶液比较,pH:前者>后者
