题目内容
(10分)为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
【查阅资料】金属活泼性不同,其硝酸盐分解产物不同
(1)K→Na活泼金属的硝酸盐分解生成亚硝酸盐和氧气;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2;
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2。
2KNO3 2KNO2↑+O2↑ 2Cu(NO3)2
2KNO2↑+O2↑ 2Cu(NO3)2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态。该小组甲同学将其溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。
【提出猜想】
猜想一:Fe元素只显+2价;
猜想二:Fe元素只显______价;
猜想三:Fe元素_________。
【实验操作】①向一份溶液中滴入KSCN溶液;②稀酸性KMnO4溶液中滴入另一份溶液。
【实验现象】实验① ;
实验② 。
【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是 。
【实验二】探究Fe(NO3)2热分解气体产物的性质。小组乙、丙同学进行了如下图所示的实验(收集时操作恰当,几乎没有空气)
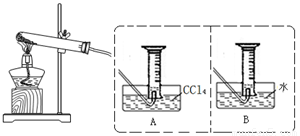
实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管,并重新连接好仪器;④加热;⑤……
(1)乙同学使用A装置收集气体,恰好收集到27mL红棕色气体,要从水槽中取出量筒,乙同学的正确操作方法是
。
(2)乙同学用带火星木条检验量筒内气体时,发现木条燃烧,下列判断中正确的是 。
a.气体中只有NO2 b.气体是O2、NO2的混合物
c.支持燃烧的气体只有O2 d.NO2支持燃烧
【实验一】【提出猜想】+3(1分) 既有+2价又有+3价(1分)
【实验现象】溶液呈血红色(1分) 稀酸性KMnO4溶液不褪色(1分)。
【实验结论】4Fe(NO3)2 2Fe2O3+8NO2↑+O2↑(2分)
2Fe2O3+8NO2↑+O2↑(2分)
【实验二】(1)用玻璃片在水槽里盖好量筒口,用食指摁紧玻璃片,将量筒从水槽里拿出来,正放在实验台上(2分)
(2)bd(2分)
【解析】
试题分析:【实验一】【提出猜想】铁元素常见的化合价有+2价和+3价
【实验现象】KSCN溶液常用来检验溶液中是否存在铁离子,若存在则溶液呈血红色;若不存在亚铁离子,则稀酸性KMnO4溶液不褪色。
【实验结论】4Fe(NO3)2 2Fe2O3+8NO2↑+O2↑
2Fe2O3+8NO2↑+O2↑
【实验二】(1)用玻璃片在水槽里盖好量筒口,用食指摁紧玻璃片,将量筒从水槽里拿出来,正放在实验台上
(2)用带火星木条检验量筒内气体时,发现木条燃烧,说明气体中含有O2并且NO2支持燃烧,故选项bd正确。
考点:铁盐的性质
点评:铁元素常见的化合价有+2价和+3价,KSCN溶液常用来检验溶液中是否存在铁离子,若存在则溶液呈血红色,用稀酸性KMnO4溶液可以检验溶液中是否存在亚铁离子,若存在,则溶液颜色变浅或褪去。

 阅读快车系列答案
阅读快车系列答案【查阅资料】2KNO3
| △ |
| △ |
实验一:探究Fe(NO3)2热分解固体产物中Fe元素的价态.该小组甲同学将分解后的固体产物溶于足量的稀
H2SO4得到相应两份溶液,进行以下探究实验.
(1)【提出猜想】
猜想一:Fe元素只显+2价;
猜想二:Fe元素
猜想三:Fe元素既有+2价又有+3价.
【实验操作】①向一份溶液中滴入KSCN溶液;②向另一份溶液中滴入酸性KMnO4稀溶液.
(2)【实验现象】实验①
(3)【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是
实验二:
(4)探究Fe(NO3)2热分解气体产物的性质.小组乙同学进行了如下实验,请完成实验空缺部分内容.限选试剂和用晶:浓 H2SO4%溶液、4mol/LNaOH溶液、0.1mol/LBaC12溶液、带火星的木条、0.1mol/L酸性KMnO4溶液、蒸馏水.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量Fe(NO3)2固体于试管中, 加热分解. |
说明分解产生的气体中含N02. |
| 步骤2:将产生的气体依次通过盛有足量 |
说明分解产生的气体中含 02. |
(5)KNO3中混有Fe(NO3)2,为确定其中铁元素的含量,小组丙同学进行如下实验:
①取混合物样品 10g,充分加热分解;
②将固体产物溶解、过滤,取沉淀进行洗涤、干燥,称得其质量为 3.2g. 则混合物中铁元素的含量为
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究:
【查阅资料】2KNO3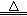 2KNO2+O2↑
Fe(NO3)2
2KNO2+O2↑
Fe(NO3)2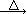 FexOy+NO2↑+O2↑
FexOy+NO2↑+O2↑
实验一:探究Fe(NO3)2热分解固体产物中铁元素的价态。该小组甲同学将分解后的固体产物溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。
(1)【提纯猜想】
猜想一:铁元素只显+2价;
猜想二:铁元素 ;
猜想三:铁元素既有+2价又有+3价。
【实验操作】①向一份溶液中滴入KSCN溶液;向另一份溶液中滴入酸性KMnO4稀溶液。
(2)【实验现象】实验① ;实验② 。
(3)【实验结论】猜想二成立,则Fe(NO3)2分解的化学方程式是 。
实验二:
(4)探究Fe(NO3)2热分解气体产物的性质。小组乙同学进行料如下实验,请完成实验空缺部分内容。限选试剂和用品:浓H2SO4溶液、4mol/LNaOH溶液、0.1mol/LBaCl2溶液、带火星的木条、0.1mol/L酸性KMnO4溶液、蒸馏水。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量Fe(NO3)2固体于试管中,加热分解。 |
,说明分解产生的气体中含有NO2。 |
|
步骤2:将产生的气体依次通过盛有足量 、浓硫酸的洗气瓶, 在最后一个出口检验。 |
,说明分解产生的气体中含O2。 |
实验三:KNO3中混有Fe(NO3)2,为确定其中铁元素的含量,小组丙同学进行如下实验:①取混合物样品10g,充分加热分解;②将固体产物溶解、过滤,取沉淀进行洗涤、干燥,称得其质量为3.2g。则混合物中铁元素的质量分数为 。(保留三位有效数字,相对原子质量:Fe-56 O-16)
 2KNO2↑+O2↑
2KNO2↑+O2↑
 【实验二】探究Fe(NO3)2热分解气体产物的性质。小组乙、丙同学进行了如下图所示的实验(收集时操作恰当,几乎没有空气)
【实验二】探究Fe(NO3)2热分解气体产物的性质。小组乙、丙同学进行了如下图所示的实验(收集时操作恰当,几乎没有空气)