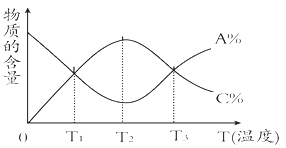
题目内容
【题目】在a LAl2(SO4)3和(NH4)2SO4的混合溶液中加入b mol的BaCl2,恰好使溶液中的SO42-离子完全沉淀;如加入足量强碱并加热可得到c molNH3,(已知NH4++OH-![]() NH3+H2O)则原溶液中的Al3+的浓度(mol/L)为 ( )
NH3+H2O)则原溶液中的Al3+的浓度(mol/L)为 ( )
A.![]() B.
B.![]() C.(4b-2c)/3a D.
C.(4b-2c)/3a D.![]()
【答案】C
【解析】
试题分析:将Al2(SO4)3和(NH4)2SO4的混合溶液a L分为两等份,每份的体积为0.5a,
向0.5aL混合溶液中加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀,则:
SO42-+Ba2+═BaSO4↓
bmol bmol
c(SO42-)=bmol/0.5aL=2b/amol/L,
向0.5aL混合溶液中加入足量强碱并加热可得到cmolNH3,则:
NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
cmol cmol
c(NH4+)=cmol/0.5aL=2c/amol/L,
又溶液不显电性,设原溶液中的Al3+浓度为x,由电荷守恒可知,
x×3+2c/amol/L×1=2b/amol/L×2,
解得x=(4b-2c)/3amol/L,故选C。

练习册系列答案
相关题目