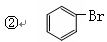
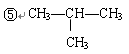
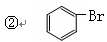
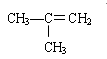题目内容
CH3-CH3→CH2=CH2+H2,有关化学键的键能如下:
计算该反应的反应热.
| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
+125.6
+125.6
kJ/mol.分析:化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答:解:在反应CH3-CH3→CH2=CH2+H2中,断裂6mol C-H键,1mol C-C键共吸收的能量为:6×414.4kJ+347.4kJ=2833.8kJ,
生成1molCH2=CH2和1molH2,共形成4molC-H键,1molC=C、1molH-H,共放出的能量为:4×414.4kJ+615.3kJ+435.3kJ=2708.2kJ,
吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2833.8kJ-2708.2kJ=125.6,所以反应热为+125.6kJ/mol,
故答案为:+125.6k.
生成1molCH2=CH2和1molH2,共形成4molC-H键,1molC=C、1molH-H,共放出的能量为:4×414.4kJ+615.3kJ+435.3kJ=2708.2kJ,
吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2833.8kJ-2708.2kJ=125.6,所以反应热为+125.6kJ/mol,
故答案为:+125.6k.
点评:本题考查反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
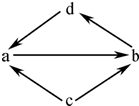 (2011?南京一模)下列各组物质巾,物质之间通过一步反应就能实现如图所示的变化的是( )
(2011?南京一模)下列各组物质巾,物质之间通过一步反应就能实现如图所示的变化的是( )