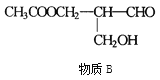
题目内容
【题目】化学兴趣小组设计以下实验方案,测定小苏打样品(含有NaHCO3和Na2CO3)中Na2CO3的质量分数。(已知2NaHCO3![]() Na2CO3 + CO2 ↑+ H2O)
Na2CO3 + CO2 ↑+ H2O)
【方案一】称取一定质量的固体样品,加热至恒重后冷却,称量剩余固体质量,计算。
(1)下列仪器中,在灼烧固体样品时用到的是____(填序号)。

A B C D
(2)若加热过程中有晶体迸溅出来,则测得的结果____(填“偏大”、“偏小”或“不变”)。
(3)实验中需加热至恒重的目的是:______________________________________________。
【方案二】称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(1)请写出足量Ba(OH)2溶液和NaHCO3发生反应的离子方程式:_____________________。
(2)实验中判断沉淀是否完全的方法是____________________________________。
(3)实验中判断沉淀是否洗涤干净的方法是___________________________________。
【方案三】按如图所示装置进行实验:

(1)B装置内所盛试剂是____;D装置的作用是_____________。
(2)检查整套实验装置气密性方法是______________________________________。
(3)经检查装置气密性良好,但根据此实验测得的数据,测定结果有误差,因为该实验装置还存在一个明显缺陷是________________________________。
【答案】 AC 保证NaHCO3分解完全 偏小 Ba2++OH-+HCO32- = BaCO3↓+H2O 取上层清液少量于干净的试管中,滴加Ba(OH)2溶液,观察是否还有白色沉淀生成 取少量最后一次洗涤沉淀的滤液于干净的试管中,滴加Na2SO4溶液,观察是否有白色沉淀生成 浓H2SO4 防止空气中的水蒸气、CO2进入C装置 关闭分液漏斗,将球形干燥管所连导管伸到水中,微热烧瓶,导管口有气泡冒出,冷却后导管出现一段稳定水柱,则气密性良好。(其他合理即可) 缺少一套将A、B内的CO2气体赶到C里的装置
【解析】试题分析:【方案一】 小苏打受热分解,根据反应前后固体质量的变化,可以测定小苏打样品中Na2CO3的质量分数。(1)灼烧固体需用到的仪器有:酒精灯、三脚架、坩埚、泥三角、坩埚钳。(2)加热至恒重的目的是保证NaHCO3分解完全。 (3)加热过程中迸溅出晶体时,最后剩余的固体质量减小,求出的小苏打的质量增大,进而求出的碳酸钠的质量减小。
【方案二】(1)足量Ba(OH)2溶液和NaHCO3发生生成碳酸钡沉淀和氢氧化钠。(2)判断沉淀是否完全的方法是:静置,向上层清液中继续滴加沉淀剂,若有沉淀生成,则说明沉淀不完全;若无沉淀生成,则说明沉淀已完全。(3)要判断沉淀是否洗干净就要分析如果没有洗净,洗涤液中含有何种易于鉴别的离子,然后取最后一次的洗涤液,选择适当的试剂进行实验。
【方案三】(1)A装置是将样品中的Na2CO3、NaHCO3完全转化为CO2,产生的CO2被C装置吸收,通过称量C装置吸收前后的质量差(即产生的CO2的质量),可以求出Na2CO3和NaHCO3的质量,进而求出小苏打样品中Na2CO3的质量分数。由于碱石灰既能吸收CO2又能吸收水蒸气,所以从A装置中出来的气体在进入C装置前,必须除去CO2气体中的水蒸气,C装置后面必须连接一防止空气中的水蒸气、CO2进入的装置。 (2) 关闭分液漏斗,将球形干燥管所连导管伸到水中,根据气体热胀冷缩原理检验装置气密性;
(3)由于A、B装置内的CO2气体无法完全进入C装置里,导致实验测得的结果有误差,应增加一套将A、B内的CO2气体驱赶到C里的装置。
解析:【方案一】 (1)灼烧固体需用到的仪器有:酒精灯、三脚架、坩埚、泥三角、坩埚钳,所以在灼烧固体样品时用到的是AC。(2)加热至恒重的目的是保证NaHCO3分解完全。 (3)加热过程中迸溅出晶体时,最后剩余的固体质量减小,所以生成二氧化碳、水的质量偏大,求出的小苏打的质量增大,进而求出的碳酸钠的质量减小。
【方案二】(1)足量Ba(OH)2溶液和NaHCO3发生生成碳酸钡沉淀和氢氧化钠,反应的离子方程式是Ba2++OH-+HCO3- = BaCO3↓+H2O。(2)判断沉淀是否完全的方法是:静置,向上层清液中继续滴加Ba(OH)2溶液,若有沉淀生成,则说明沉淀不完全;若无沉淀生成,则说明沉淀已完全。(3)若没有洗干净,会含有OH--、Ba2+、HCO3-、CO32-,现象明显的是用SO42-鉴别Ba2+,所以取少量最后一次洗涤沉淀的滤液于干净的试管中,滴加Na2SO4溶液,观察是否有白色沉淀生成,若有白色沉淀生成说明没有洗干净,若没有白色沉淀生成说明已经洗干净;
【方案三】(1)根据以上分析,由于碱石灰既能吸收CO2又能吸收水蒸气,所以从A装置中出来的气体在进入C装置前,必须除去CO2气体中的水蒸气,所以B装置中所盛试剂是浓硫酸,C装置后面连接D装置,防止空气中的水蒸气、CO2进入C装置。(2) 关闭分液漏斗,将球形干燥管所连导管伸到水中, 微热烧瓶,导管口有气泡冒出,冷却后导管出现一段稳定水柱,则气密性良好。
(3)由于A、B装置内的CO2气体无法完全进入C装置里,导致实验测得的结果有误差,应增加一套将A、B内的CO2气体驱赶到C里的装置。

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
已知:甲苯的熔点为﹣95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;
苯甲酸的熔点为122.4℃,在25℃和95℃下在水中溶解度分别为0.344g和6.8g。
Ⅰ.【制备产品】将30.0mL甲苯和25.0mL 1mol/L高锰酸钾溶液在100℃下反应30min,装置如图1所示:

(1)仪器A的名称为________,A的进水口为___(填“a”或“b”)。支管的作用是____________。
(2)在本实验中,三颈烧瓶最合适的容积是____(填字母).
A.50mL B.100mL C.250mL D.500mL
Ⅱ.【分离产品】该同学设计如图2流程分离粗产品苯甲酸和回收甲苯。

(3)操作Ⅰ的名称是________;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是_________。
Ⅲ.【纯度测定】称取1.220g白色固体,配成100mL甲醇溶液,取25.00mL溶液,用0.1000mol/LKOH标准溶液滴定,重复滴定四次,每次消耗的体积如表所示.
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(4)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果______(填“偏大”、“偏小”或“不变”).计算样品中苯甲酸纯度为_________。
(5)从白色固体B中得到纯净的苯甲酸的实验方法是:____________________。