题目内容
甲烷是最简单的有机物,实验室可通讨下列反应制取:CH3COONa+NaOH
| CaO(或MgO) | △ |
(1)X属于
(2)MgO晶体的熔点比CaO高,主要原因是
(3)Mg的第二电离能小于Na的第二电离能的原因是
分析:(1)根据原子守恒判断X物质,根据X的构成微粒确定其晶体类型;
(2)相同类型的离子晶体中,晶体的熔点与晶格能成正比,晶格能与离子半径成反比;
(3)Na+最外层第二层全满处于稳定结构,Mg+的3s处于半满不稳定状态.
(2)相同类型的离子晶体中,晶体的熔点与晶格能成正比,晶格能与离子半径成反比;
(3)Na+最外层第二层全满处于稳定结构,Mg+的3s处于半满不稳定状态.
解答:解:(1)根据元素守恒及原子守恒知,X是碳酸钠,碳酸钠是由阴阳离子构成的离子晶体,
故答案为:离子;
(2)MgO晶体的熔点比CaO高都属于离子晶体,Mg2+半径比Ca2+小,键能较大,所以氧化镁晶体的晶格能大于氧化钙,导致氧化镁晶体的熔点大于氧化钙,故答案为:Mg2+半径比Ca2+小,MgO的晶格能较大;
(3)当失去一个电子后,Na+最外层第二层填充8个电子为稳定结构,而Mg+3s1尚未达到稳定结构,所以失去第二个电子Na比Mg需要更多能量,所以Na第二电离能大于Mg,
故答案为:Na+处于全满稳定状态,Mg+的3s能级处于半满不稳定状态.
故答案为:离子;
(2)MgO晶体的熔点比CaO高都属于离子晶体,Mg2+半径比Ca2+小,键能较大,所以氧化镁晶体的晶格能大于氧化钙,导致氧化镁晶体的熔点大于氧化钙,故答案为:Mg2+半径比Ca2+小,MgO的晶格能较大;
(3)当失去一个电子后,Na+最外层第二层填充8个电子为稳定结构,而Mg+3s1尚未达到稳定结构,所以失去第二个电子Na比Mg需要更多能量,所以Na第二电离能大于Mg,
故答案为:Na+处于全满稳定状态,Mg+的3s能级处于半满不稳定状态.
点评:本题考查离子晶体的相关知识,难度不大,掌握原子或离子的核外电子排布是解题的基础,晶格能的大小比较是离子晶体的难点.

练习册系列答案
相关题目

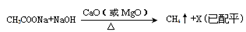 ,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。 CH4↑+X(已配平)
CH4↑+X(已配平)