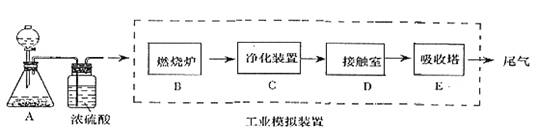
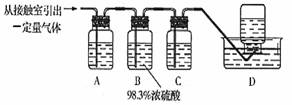
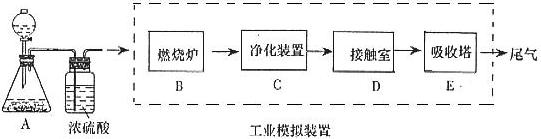
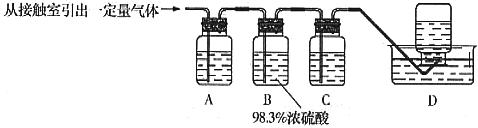
题目内容
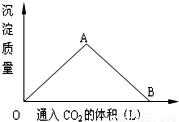
如图为一定量的饱和Ca(OH)2澄清溶液中通入二氧化碳气体后,产生碳酸钙白色沉淀的质量与通入二氧化碳气体体积的关系曲线,请回答下列问题:(1)写出O-A段曲线与A-B段曲线所表现的离子方程式:
OA:______,AB:______;
(2)A点处,参加反应的二氧化碳与氢氧化钙的物质的量之比为:______;
(3)B点处,溶液中存在离子的浓度最大的两种离子是:______.
【答案】分析:饱和Ca(OH)2澄清溶液中通入二氧化碳气体随着二氧化碳量的增多发生的反应不同,根据化学反应方程式结合图象来回答.
解答:解:(1)饱和Ca(OH)2澄清溶液中通入二氧化碳气体随着二氧化碳量的增加发生的反应依次为:Ca2++2OH-+CO2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca2++2HCO3-,所以O-A段曲线表示的反应为Ca2++2OH-+CO2=CaCO3↓+H2O,A-B段曲线所表现的离子方程式为CaCO3+CO2+H2O=Ca2++2HCO3-,故答案为:Ca2++2OH-+CO2=CaCO3↓+H2O;CaCO3+CO2+H2O=Ca2++2HCO3-;
(2)A点处,二氧化碳与氢氧化钙的反应Ca2++2OH-+CO2=CaCO3↓+H2O正好达到沉淀量最大,所以参加反应的二氧化碳与氢氧化钙的物质的量之比为1:1,故答案为:1:1;
(3)B点处,沉淀恰好溶解完全,所得溶液为碳酸氢钙,所以溶液中存在离子的浓度最大的两种离子是:Ca2+、2HCO3-,故答案为:Ca2+、2HCO3-.
点评:本题考查学生化学方程式的书写知识,考查学生分析和解决问题的能力,难度较大.
解答:解:(1)饱和Ca(OH)2澄清溶液中通入二氧化碳气体随着二氧化碳量的增加发生的反应依次为:Ca2++2OH-+CO2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca2++2HCO3-,所以O-A段曲线表示的反应为Ca2++2OH-+CO2=CaCO3↓+H2O,A-B段曲线所表现的离子方程式为CaCO3+CO2+H2O=Ca2++2HCO3-,故答案为:Ca2++2OH-+CO2=CaCO3↓+H2O;CaCO3+CO2+H2O=Ca2++2HCO3-;
(2)A点处,二氧化碳与氢氧化钙的反应Ca2++2OH-+CO2=CaCO3↓+H2O正好达到沉淀量最大,所以参加反应的二氧化碳与氢氧化钙的物质的量之比为1:1,故答案为:1:1;
(3)B点处,沉淀恰好溶解完全,所得溶液为碳酸氢钙,所以溶液中存在离子的浓度最大的两种离子是:Ca2+、2HCO3-,故答案为:Ca2+、2HCO3-.
点评:本题考查学生化学方程式的书写知识,考查学生分析和解决问题的能力,难度较大.

练习册系列答案
相关题目
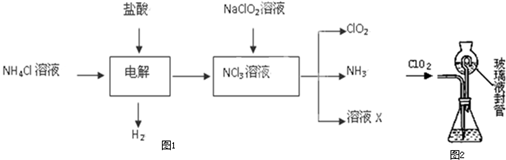
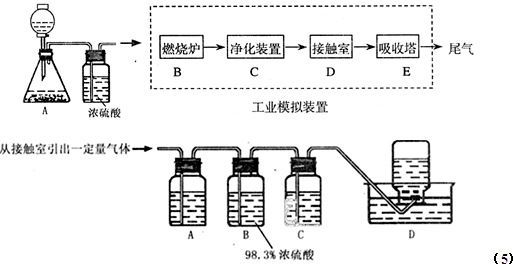
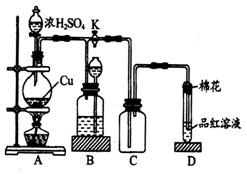
 到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。