题目内容
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1mol氯气参加氧化还原反应,转移的电子数一定为2NA |
| B.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA |
| C.12 g石墨和C60的混合物中质子总数为6NA个 |
| D.常温常压下,22.4L乙烯中C?H键数为4NA |
C
解析试题分析:A、1mol氯气参加氧化还原反应,转移的电子数不一定为2NA,如1mol氯气与水反应,转移电子数是1 NA,错误;B、pH=12即c(OH-)=0.01mol/L,但无法计算Na2CO3的浓度,所以Na+的数目无法计算,错误;C、石墨与C60的的构成微粒都是碳原子,12g的二者混合物即有1mol的碳原子,则质子总数为6NA个,正确;D、非标准状况下,气体摩尔体积不一定是22.4L/mol,错误,答案选C。
考点:考查阿伏伽德罗常数的理解应用

用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是
| A.称量 | B.溶解 | C.转移 | D.定容 |
以NA代表阿伏加德罗常数的值,下列说法申正确的是
| A.9g18O2含有的中子数为5NA |
| B.标准状况下,0.5NABr2所占的体积约为11.2L |
| C.常温下,1L0.1mol·L-1NH4NO3溶液中含有的NH4+数为0.1NA |
| D.一定条件下,lmol N2和3mol H2在密闭容器充分反应,生成N-H键的数目为6NA |
将碳酸钠和碳酸氢钠的固体混合物Wg溶于水制成500mL溶液,钠离子的物质的量浓度为0.2mol?L-1,若将Wg该混合物用酒精灯加热至质量不再改变时,得到的固体物质的质量可能是
| A.5.3g | B.10.6g | C.4.2g | D.3.1g |
某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
①该氯原子的相对原子质量为12a/b
②m g该氯原子的物质的量为m/(aNA)mol
③该氯原子的摩尔质量是aNA g
④a g该氯原子所含的电子数为17 mol
| A.①③ | B.②④ | C.①② | D.②③ |
将氢气通过10gCuO粉末加热片刻,冷却后剩余固体的质量为8.4g,那么下列计算正确的是( )
| A.有1.6gH2O生成 |
| B.有8.4gCu生成 |
| C.有80%的CuO被还原 |
| D.实验过程中所消耗的氢气为0.2g |
下列指定微粒的数目相等的是( )
| A.物质的量相等的H2O与D2O含有的中子数 |
| B.20 mL NH3和30 mL O2所含的原子数 |
| C.等物质的量的Na2O和Na2O2中含有的阴离子总数 |
| D.等物质的量的钠和铜分别与氯气完全反应,转移的电子数 |
下列表格中的各种情况,可以用如图所示曲线表示的是( )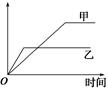
| 选项 | 反应 | 纵坐标 | 甲 | 乙 |
| A | 相同质量的氨气,在同一容器中发生反应:2NH3 N2+3H2 N2+3H2 | 氨气的转化率 | 500 ℃ | 400 ℃ |
| B | 等质量的钾、钠分别与足量的水反应 | H2的质量 | 钠 | 钾 |
| C | 在体积可变的恒压容器中,体积之比为1∶3的N2、H2:N2+3H2 2NH3 2NH3 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
| D | 2 mol SO2和1 mol O2在相同温度下发生反应:2SO2+O2 2SO3 2SO3 | SO3的物质的量 | 2个大气压 | 10个大气压 |
某混合气体X,可能由H2、CO、CO2和水蒸气中的一种或几种组成,现将混合气体通入灼热的CuO,完全反应后,固体CuO质量减少1.6 g;再将反应后的混合气体全部导入足量的澄清石灰水中,生成白色沉淀10 g。根据以上信息,分析下列有关X的组成推断正确的是( )
| A.X一定只由CO组成 |
| B.X一定只由H2和CO2组成 |
| C.X可能由0.1 g H2和4.4 g CO2组成 |
| D.X可能由0.1 g H2、1.4 g CO、2.2 g CO2组成 |