题目内容
PM2.5细颗粒物含有的毒性物质来源之一是汽车尾气排放。通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为:NOx + CO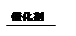 N2 + CO2,下列关于此反应的说法中,错误的是( )
N2 + CO2,下列关于此反应的说法中,错误的是( )
A.所涉及元素中原子半径: C>N>O
B.氧化剂与还原剂的物质的量之比为1︰1时,NOx中氮元素的化合价为+2价
C.当x = 2时,每生成1mol N2,转移电子数为4mol ,N2为氧化产物
D.等物质的量N2和CO2中,共价键的个数比为3︰4
【答案】
C
【解析】
试题分析:同周期自左向右原子半径逐渐减小,A正确;反应中碳元素的化合价从+2价升高到+4价,生气2个电子。氮元素被还原到0价,所以如果氧化剂与还原剂的物质的量之比为1︰1时,NOx中氮元素的化合价为+2价,B正确;C不正确,当x=2时,每生成1mol N2,转移电子数为8mol ,N2为还原产物,C不正确;氮气中含有三键,CO2中含有2个双键,所以选项D正确,答案选C。
考点:考查原子半径、化合价、氧化还原反应以及化学键的判断和计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重考查学生基础知识的同时,侧重考查学生灵活运用基础知识解决实际问题的能力。有助于培养学生的逻辑推理能力,提升学生的学科素养和学习兴趣。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
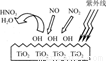
 HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是
。
HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是
。