题目内容
【题目】pH=0的某溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验:
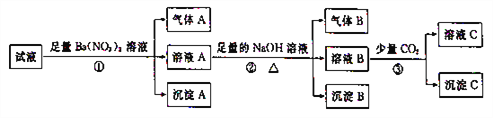
下列有关判断正确的是
A. 试液中一定有Fe2+、SO42-、H+、NH4+、A13+
B. 试液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中一定发生反应:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 气体A与气体B不可能发生化学反应
【答案】B
【解析】pH=0溶液显酸性,原溶液中不含CO32-,加入足量Ba(NO3)2有气体生成,利用NO3-在酸性条件下表现强氧化性,Fe2+氧化成Fe3+,本身被还原成NO,因此原溶液中有Fe2+,不含NO3-,加入硝酸钡,产生沉淀A,沉淀是BaSO4,因此原溶液中不含SO42-,根据电荷守恒,原溶液中一定含有Cl-,加入足量的NaOH溶液,出现气体,此气体为NH3,说明原溶液中一定含有NH4+,沉淀B为Fe(OH)3,溶液B中加入少量CO2,溶液B中含有Ba2+和OH-,沉淀C一定是BaCO3,可能含有Al(OH)3,总上所述,原溶液中一定含有Fe2+、NH4+、H+、Cl-、SO42-,一定不含有Ba2+、NO3-、CO32-,可能含有Al3+,故A错误,B正确,步骤③一定发生Ba2++2OH-+CO2=BaCO3↓+H2O,故C错误;气体A是NO,气体B为NH3,两者在一定条件下发生反应生成N2和H2O,故D错误。

练习册系列答案
相关题目