题目内容
【题目】X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物 ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为 ;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式);
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有 、
(写出其中两种物质的化学式);
(4)ZX与水反应放出气体的化学方程式为 ;
(5)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。元素 E位于第四周期,与元素 Y同主族。在下表中列出对 H2EO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中 E用元素符号表示)
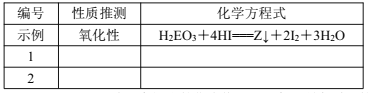
(6)由碳元素(C)、Y和 M三种元素组成的化合物 CYM中,所有原子的最外层满足 8电子结构。写出该化合物的电子式(电子式中 Y、M用元素符号表示)______________________。
【答案】(20分,除特殊标注外,余下每空2分)
(1)第二周期第ⅥA族 (2)HClO4;H2S
(3)Cl2、O3、ClO2(任写两种,其他合理答案均可)
(4)NaH+H2O===NaOH+H2↑
(5)[其中还原性,氧化性(各1分)]
1 | 还原性 | Br2+H2SeO3+H2O===H2SeO4+2HBr(或其他合理答案) |
2 | 酸性 | H2SeO3+2NaOH===Na2SeO3+2H2O (或其他合理答案) |
(6)![]()
【解析】试题分析:X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大,所以X是H元素;X、Z同主族,可形成离子化合物ZX,且Z原子序数大于Y原子序数,所以Z是Na元素;Y、M同主族,可形成MY2、MY3两种分子,所以Y是O元素,M是S元素,G是短周期主族元素,所以G是Cl元素。
(1)Y为O元素,在元素周期表中的位置为:第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4,S元素非金属性最弱,非金属气态氢化物还原性最强的是H2S,故答案为:HClO4;H2S;(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有:Cl2、O3、ClO2等,故答案为:Cl2、O3等;(4)NaH与水反应放出气体的化学方程式为:NaH+H2O=NaOH+H2↑,故答案为:NaH+H2O=NaOH+H2↑;(5)元素E位于第四周期,与元素Y同主族,则E为Se,H2SeO3与H2SO3相似,具有氧化性、还原性和酸性,如反应:2H2SeO3+O2═2H2SeO4(或Br2+H2SeO3+H2O═H2SeO4+2HBr)中表现还原性,反应H2SeO3+2NaOH═Na2SeO3+2H2O表现酸性。(6)由C、O和S三种元素组成的化合物COS中,所有原子的最外层都满足8电子结构,则C原子与O原子之间形成2对个共用电子对、C原子与S原子之间形成2对共用电子对,COS的电子式为![]() 。
。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
