题目内容
亚硝酸钠(NaNO2)暴露于空气中会与氧气反应生成硝酸钠,在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH—==2NO2—+H2O ②气体液化的温度:NO2:21℃,NO:-152℃
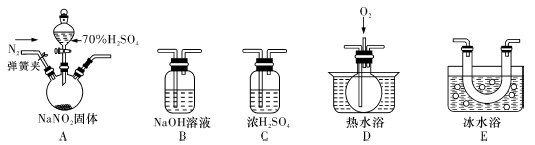
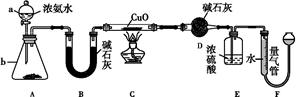
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):A、C、 、 、 。
(2)反应前应打开弹簧夹,先通人一段时间氮气,排除装置中的空气,目的是 。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴人70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 。
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。如果没有装置C,对实验结论造成的影响是 。
(5)通过上述实骏探究过程,可得出装置A中反应的化学方程式是 。
已知:①NO+NO2+2OH—==2NO2—+H2O ②气体液化的温度:NO2:21℃,NO:-152℃

(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):A、C、 、 、 。
(2)反应前应打开弹簧夹,先通人一段时间氮气,排除装置中的空气,目的是 。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴人70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 。
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。如果没有装置C,对实验结论造成的影响是 。
(5)通过上述实骏探究过程,可得出装置A中反应的化学方程式是 。
(1)E、D、B(2)防止可能生成的NO被氧化成NO2,造成对A中反应气体产物检验造成干扰
(3)①D中通入氧气后,出现红棕色气体 ②冷凝,使NO2完全液化
(44NO+O2+4NaOH=2H2O+4NaNO3水蒸气存在,会与NO2反应产生NO,造成对NO的来源认识不清
(5)2NaNO2+H2SO4 NO↑+NO2↑+Na2SO4+H2O。
NO↑+NO2↑+Na2SO4+H2O。
(3)①D中通入氧气后,出现红棕色气体 ②冷凝,使NO2完全液化
(44NO+O2+4NaOH=2H2O+4NaNO3水蒸气存在,会与NO2反应产生NO,造成对NO的来源认识不清
(5)2NaNO2+H2SO4
 NO↑+NO2↑+Na2SO4+H2O。
NO↑+NO2↑+Na2SO4+H2O。试题分析:(1)在A装置中可能发生的反应有:2NaNO2+H2SO4(浓)
 Na2SO4+2HNO2,2HNO2
Na2SO4+2HNO2,2HNO2 NO↑+NO2↑+H2O。由于气体液化的温度:NO2:21℃,NO:-152℃,所以NO2首先液化,要先用E检验,然后用D装置根据2NO+O2= 2NO2无色气体变为红棕色来验证NO的存在。NO、NO2都是大气污染物,最后要进行尾气处理,用B装置的NaOH溶液来吸收。为了检验装置A中生成的气体产物,仪器的连接顺序是 A、C、E、D、B。(2)反应前应打开弹簧夹,先通人一段时间氮气,排除装置中的空气,是为了防止可能生成的NO被氧化成NO2,造成对A中反应气体产物检验造成干扰。
NO↑+NO2↑+H2O。由于气体液化的温度:NO2:21℃,NO:-152℃,所以NO2首先液化,要先用E检验,然后用D装置根据2NO+O2= 2NO2无色气体变为红棕色来验证NO的存在。NO、NO2都是大气污染物,最后要进行尾气处理,用B装置的NaOH溶液来吸收。为了检验装置A中生成的气体产物,仪器的连接顺序是 A、C、E、D、B。(2)反应前应打开弹簧夹,先通人一段时间氮气,排除装置中的空气,是为了防止可能生成的NO被氧化成NO2,造成对A中反应气体产物检验造成干扰。(3)①D中气体是无色的,当通入氧气后,出现红棕色气体。②装置E的作用是冷凝,使NO2完全液化
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为4NO+O2+4NaOH=2H2O+4NaNO3如果没有装置C,产生的气体中含有的水蒸气,就会与NO2发生反应:3NO2+H2O=2HNO3+NO。产生了NO,造成对NO的来源认识不清。影响判断结果的正确性。(5)通过上述实骏探究过程,可得出装置A中反应的化学方程式是2NaNO2+H2SO4(浓)
 Na2SO4+2HNO2,2HNO2
Na2SO4+2HNO2,2HNO2 NO↑+ NO2↑ +H2O。叠加得到总方程式为:2NaNO2+H2SO4
NO↑+ NO2↑ +H2O。叠加得到总方程式为:2NaNO2+H2SO4 NO↑+NO2+Na2SO4+H2O
NO↑+NO2+Na2SO4+H2O
练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目