题目内容
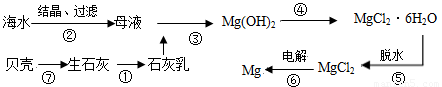
海水中提取镁的工业流程如下图所示:? ?
?
仔细分析该图所示的工业流程,探究:?
(1)从海水中的Mg2+到金属Mg,经历了哪些反应过程??
(2)在用上述方法提取镁的过程中,采取了哪些措施来提高经济效益?这对你有什么提示?
解析:(1)由流程图可以得出,海水中的Mg2+到金属Mg,经历的主要变化的方程式有:①CaCO3![]() CaO+CO2↑,②CaO+H2O
CaO+CO2↑,②CaO+H2O![]() Ca(OH)2 ,③Mg2++2OH-
Ca(OH)2 ,③Mg2++2OH-![]() Mg(OH)2↓,④Mg(OH)2+2HCl
Mg(OH)2↓,④Mg(OH)2+2HCl![]() MgCl2+2H2O,④MgCl2
MgCl2+2H2O,④MgCl2![]() Mg+Cl2↑。 ?
Mg+Cl2↑。 ?
(2)从经济角度应考虑以下几点:工厂应设在海边。需要的碱取自海边的贝壳(CaCO3),CaCO3分解产生的CaO再与水反应即得碱〔Ca(OH)2〕。电解MgCl2制镁时产生的氯气又可作为制取盐酸的材料。制得的盐酸再跟Mg(OH)2反应进入循环,提高了经济效益。?
答案:略。

练习册系列答案
相关题目
海水中提取镁的工业流程如下图所示: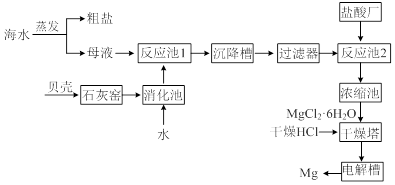
回答下列问题。
⑴用贝壳而不从异地山中开凿石灰石的原因是______________________________。
⑵母液中含有MgCl2,写出反应池1的离子方程式_________________________。
⑶反应池1中,加入Ca(OH)2,使溶液的pH为11时,认为Mg2+沉淀完全[c(Mg2+)<1×10-5mol·L-1],则Mg(OH)2的溶度积约为_______________________。
⑷干燥塔中,在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是_______________________________________________________________。
⑸电解槽中先得到的是镁的蒸气,镁蒸气可以在下列_____(填编号)气体氛围中冷却。
| A.空气 | B.氧气 | C.水蒸气 | D.氢气 |
反应①:____________________________________________________________;
反应②:____________________________________________________________。
 ?
?