题目内容
在一定条件下,使H2和O2的混合气体26g充分发生反应。所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2g。求原混合气体中O2和H2的质量。
O2的质量24 g或16 g H2质量2 g或10 g
2Na2O2+2H2O=4NaOH+O2↑
每当36 g H2O反应,则放出32 g O2,固体增重4 g。
设x g H2O反应,固体增重2 g。
x=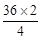 =18,故知有18 g H2O参加反应。
=18,故知有18 g H2O参加反应。
18 g H2O是由2 g H2和16 g O2反应生成的,过量未参加反应的气体为
26 g-18 g="8" g
(1)若过量的气体是8 g O2,则原混合气体中
O2:8 g+16 g="24" g H2:2 g
(2)若过量的气体是8 g H2,则原混合气体中
O2:16 g H2:8 g+2 g="10" g
每当36 g H2O反应,则放出32 g O2,固体增重4 g。
设x g H2O反应,固体增重2 g。
x=
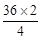 =18,故知有18 g H2O参加反应。
=18,故知有18 g H2O参加反应。18 g H2O是由2 g H2和16 g O2反应生成的,过量未参加反应的气体为
26 g-18 g="8" g
(1)若过量的气体是8 g O2,则原混合气体中
O2:8 g+16 g="24" g H2:2 g
(2)若过量的气体是8 g H2,则原混合气体中
O2:16 g H2:8 g+2 g="10" g

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
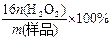 ]来衡量过碳酸钠产品的优劣,13%以上者为优等品。
]来衡量过碳酸钠产品的优劣,13%以上者为优等品。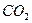 和NO的混合气体40ml。,缓缓通人盛足量
和NO的混合气体40ml。,缓缓通人盛足量 的装置后,体积缩小到20mL,则混合气体中
的装置后,体积缩小到20mL,则混合气体中