题目内容
2.苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效,主要酸性物质为苹果酸.苹果酸在分离提纯后的化学分析如下:①相对分子质量不超过150,完全燃烧后只生成CO2和H2O,分子中C.H质量分数分别为w(C)=35.82%.w(H)=4.48%;
②1mol该酸与足量的NaHCO3反应放出44.8L CO2,与足量的Na反应放出33.6L H2(气体体积均已折算为标准状况);
③该分子中存在三种化学环境不同的碳原子,氢原子也处于三种不同的化学环境.
回答下列问题:
(1)苹果酸的分子式为C4H6O5
(2)写出苹果酸的结构简式
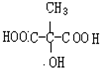 .写出苹果酸反生消去反应的方程式
.写出苹果酸反生消去反应的方程式 $→_{△}^{浓硫酸}$CH2=C(COOH)2+H2O
$→_{△}^{浓硫酸}$CH2=C(COOH)2+H2O(3)苹果酸的同分异构体中,符合上述①、②两个条件的有(写出结构简式):
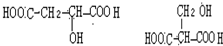 .
.
分析 (1)苹果酸分子中w(C)=35.82%,w(H)=4.48%,则O的质量分数为1-35.82%-4.48%=59.7%,相对分子质量不超过150,则O原子最大数目=$\frac{150×59.7%}{16}$=5.6,1mol苹果酸与足量的NaHCO3反应放出44.8L CO2,二氧化碳物质的量为2mol,说明分子中含有2个-COOH,与足量的Na反应放出33.6L H2,生成氢气为1.5mol,2mol-COOH含有生成1mol氢气,故分子中还含有1个-OH,综上所述苹果酸分子含有5个O原子,则苹果酸的相对分子质量=$\frac{5×16}{59.7%}$=134,根据C、H元素质量分数计算分子中C、H原子数目,进而确定分子式,则分子中C原子数目=$\frac{134×35.82%}{12}$=4,H原子数目=$\frac{134×4.48%}{1}$=6,则分子式为C4H6O5,分子中存在3种化学环境不同的碳原子,氢原子处于3种不同的化学环境,其结构简式为, ,据此解答.
,据此解答.
解答 解:(1)苹果酸分子中w(C)=35.82%,w(H)=4.48%,则O的质量分数为1-35.82%-4.48%=59.7%,相对分子质量不超过150,则O原子最大数目=$\frac{150×59.7%}{16}$=5.6,1mol苹果酸与足量的NaHCO3反应放出44.8L CO2,二氧化碳物质的量为2mol,说明分子中含有2个-COOH,与足量的Na反应放出33.6L H2,生成氢气为1.5mol,2mol-COOH含有生成1mol氢气,故分子中还含有1个-OH,综上所述苹果酸分子含有5个O原子,则苹果酸的相对分子质量=$\frac{5×16}{59.7%}$=134,则分子中C原子数目=$\frac{134×35.82%}{12}$=4,H原子数目=$\frac{134×4.48%}{1}$=6,则分子式为C4H6O5,
故答案为:C4H6O5;
(2)苹果酸分子含有2个-COOH、1个-OH,该分子中存在3种化学环境不同的碳原子,氢原子处于3种不同的化学环境,其结构简式为, ,苹果酸反生消去反应的方程式:
,苹果酸反生消去反应的方程式: $→_{△}^{浓硫酸}$CH2=C(COOH)2+H2O,
$→_{△}^{浓硫酸}$CH2=C(COOH)2+H2O,
故答案为: ;
; $→_{△}^{浓硫酸}$CH2=C(COOH)2+H2O;
$→_{△}^{浓硫酸}$CH2=C(COOH)2+H2O;
(3)苹果酸的同分异构体中,符合上述①、②两个条件,即分子中含有2个-COOH、1个-OH,符合条件的同分异构体为: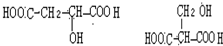 ,
,
故答案为: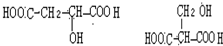 .
.
点评 本题考查有机物的推断,属于计算型推断,确定分子含有O原子数目是关键,需要学生熟练掌握醇、羧酸的性质,题目难度中等.

| A. | 将少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 盛放烧碱溶液不用玻璃塞的原因:SiO2+2OH-=SiO32-+H2O | |
| C. | 向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3•H2O | |
| D. | 浓硝酸长期放置:4HNO3=4NO↑+3O2↑+2H2O |
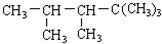 ,则该二烯烃与Br21:1加成后的产物可能有( )
,则该二烯烃与Br21:1加成后的产物可能有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
四种方法在工业上均有应用,古代有(Ⅰ)火烧孔雀石法炼铜,(Ⅱ)湿法炼铜,现代有(Ⅲ)铝热法炼铬,(Ⅳ)从光卤石(KCl•MgCl2•6H2O)中炼镁,对它们的冶炼方法分析不正确的是( )
| A. | (Ⅰ)用 ① | B. | (Ⅱ)用 ② | C. | (Ⅲ)用 ③ | D. | (Ⅳ)用 ④ |
| A. | 沸点由高到低顺序排列为新戊烷>异戊烷>正戊烷 | |
| B. | FeCl3溶液可以把5种无色溶液:乙醇、苯酚、AgNO3溶液、KOH溶液,氢硫酸一一区分 | |
| C. | 光照下2,2-二甲基丙烷与Br2反应其二溴取代物有两种 | |
| D. | 分子量为104的烃可能是芳香烃,也可能发生加聚反应,但分子中不可能都是单键 |
| A. | 海水既苦又涩,不能直接利用 | |
| B. | 海水资源的利用包括海水水资源利用和化学资源利用 | |
| C. | 海水中某些金属元素总储量很大,但富集程度却很低 | |
| D. | 海水淡化应同化工生产结合,同能源技术结合 |
| A. | 通过足量的NaOH溶液 | B. | 通过足量的酸性KMnO4溶液 | ||
| C. | 在Ni催化、加热条件下通入H2 | D. | 通过足量的溴水 |
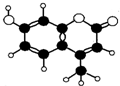 香豆素-4是一种激光染料,香豆素-4由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
香豆素-4是一种激光染料,香豆素-4由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )