题目内容
下列叙述中一定正确的是( )
| A、任何浓度溶液的酸碱性都可用pH试纸测定 | B、某温度下,pH=6.2的纯水显酸性 | C、25℃时,pH=1的醋酸溶液中c(H+)是pH=2的盐酸溶液中c(H+)的10倍 | D、25℃时,pH=12的NaOH溶液中的n(OH-)=10-2mol |
分析:A、pH试纸的测定分为0-14,溶液中氢离子或氢氧根离子浓度大于1mol/L时,无法使用pH试纸测定;
B、水的电离为吸热反应,温度升高,水的电离程度增大,水的离子积增大,氢离子浓度增大,但是纯水中氢离子浓度等于氢氧根离子浓度,溶液显示中性;
C、25℃时,pH=1的醋酸溶液中c(H+)=0.1mol/L,pH=2的盐酸溶液中c(H+)=0.01mol/L;
D、25℃时,pH=12的NaOH溶液中的c(OH-)=10-2mol,溶液体积不知,无法计算溶液中氢氧根离子的物质的量.
B、水的电离为吸热反应,温度升高,水的电离程度增大,水的离子积增大,氢离子浓度增大,但是纯水中氢离子浓度等于氢氧根离子浓度,溶液显示中性;
C、25℃时,pH=1的醋酸溶液中c(H+)=0.1mol/L,pH=2的盐酸溶液中c(H+)=0.01mol/L;
D、25℃时,pH=12的NaOH溶液中的c(OH-)=10-2mol,溶液体积不知,无法计算溶液中氢氧根离子的物质的量.
解答:解:A、用pH试纸可以测定溶液的酸碱度,其范围是0~14,强酸性或者强碱性的溶液无法使用试纸测定,故A错误;
B、某温度下,pH=6.2的纯水中,c(H+)=c(OH-),纯水显示中性,故B错误;
C、25℃时,pH=1的醋酸溶液中c(H+)为0.1mol/L,pH=2的盐酸溶液中c(H+)=0.01mol/L,所以25℃时,pH=1的醋酸溶液中c(H+)是pH=2的盐酸溶液中c(H+)的10倍,故C正确;
D、没有告诉氢氧化钠溶液的体积,无法计算溶液中氢氧根离子的物质的量,故D错误;
故选C.
B、某温度下,pH=6.2的纯水中,c(H+)=c(OH-),纯水显示中性,故B错误;
C、25℃时,pH=1的醋酸溶液中c(H+)为0.1mol/L,pH=2的盐酸溶液中c(H+)=0.01mol/L,所以25℃时,pH=1的醋酸溶液中c(H+)是pH=2的盐酸溶液中c(H+)的10倍,故C正确;
D、没有告诉氢氧化钠溶液的体积,无法计算溶液中氢氧根离子的物质的量,故D错误;
故选C.
点评:本题考查了溶液pH的简单计算、水的电离及其影响因素、试纸的使用方法,题目难度中等,注意掌握溶液酸碱性与溶液的pH之间的关系,明确pH试纸测定范围.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
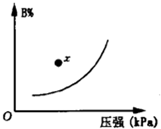 可逆反应mA(s)+nB(g)?pC(g);△H<0.在一定温度下,平衡时B的体积分数(B%)与压强的关系如图所示,下列叙述中一定正确的是( )
可逆反应mA(s)+nB(g)?pC(g);△H<0.在一定温度下,平衡时B的体积分数(B%)与压强的关系如图所示,下列叙述中一定正确的是( )| A、m+n>p | B、升高温度平衡向正反应方向移动 | C、x点时正反应速率大于逆反应速率 | D、升高温度,逆反应速率增大,正反应速率减小 |
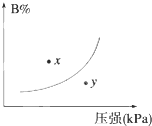 反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )