题目内容
(16分)
(1)1840年前后,瑞士科学家盖斯(Hess)指出,一个化学反应的热效应,仅与反应物的最初状态及生成物的最终状态有关,而与中间步骤无关,这就是著名的“盖斯定理”。现已知,在101 kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3 kJ·mol-1、285.8 kJ·mol-1和393.5 kJ·mol-1,则反应C(s)+2H2(g)= CH4(g)的反应热ΔH=__________,根据以上信息,你认为“盖斯定理”在我们确定一些化学反应的反应热时有何重要意义?__________。
(2)已知:2H2(g)+O2(g)====2H2O(g) ΔH1
2H2(g)+O2(g) ====2H2O(l) ΔH2
2CO(g)+O2(g)====2CO2(g) ΔH3
①写出液态水转化为气态水的热化学方程式:___________________________________。
②CO和H2分别燃烧生成CO2(g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是__________。
解析:略

(16分)填空
(1)在1~18号元素中,除稀有气体元素外:
原子半径最大的元素是 , 电负性最大的元素_______________(用元素符号表示)
(2) 某元素 +3价离子的3d轨道半充满,该元素为_______(用元素符号表示)
(3)某元素的原子的价电子构型为4S24P1,它在周期表中的位置是 _______;最高正化合价_______;
(4)下表是短周期元素一些气态原子失去核外不同电子所需的能量,(即电离能,单位为kJ?mol-1):
电离能 | 锂 | X | Y |
I1 | 519 | 502 | 580 |
I2 | 7296 | 4570 | 1820 |
I3 | 11799 | 6920 | 2750 |
I4 |
| 9550 | 11600 |
表中X元素为 (填元素符号)。Y是周期表中 族元素。
(5)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,该元素基态原子的电子排布为 。

 进行此步操作时应关闭_________,打开_________ (填k1、k2或k3);
进行此步操作时应关闭_________,打开_________ (填k1、k2或k3);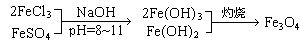
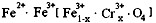 ,现有15.2
g
FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为
。
,现有15.2
g
FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为
。