题目内容
Al2(SO4)3、K2SO4、KAl(SO4)2的混合溶液100mL中,如果SO42-的浓度为0.8mol/L,当加入2mol/L的KOH溶液100mL时,生成沉淀恰好溶解,则原混合物中K+的物质的量浓度是
- A.0.2mol/L
- B.0.1mol/L
- C.0.45mol/L
- D.0.225mol/L
B
氢氧化钾是0.2mol,所以根据方程式Al3++4OH-=AlO2-+2H2O可知,原溶液中铝离子的物质的量是0.05mol,浓度是0.5mol/L,所以根据电荷守恒可知,原溶液中钾离子的浓度是0.8mol/L×2-0.5mol/L×3=0.1mol/L,答案选B。
氢氧化钾是0.2mol,所以根据方程式Al3++4OH-=AlO2-+2H2O可知,原溶液中铝离子的物质的量是0.05mol,浓度是0.5mol/L,所以根据电荷守恒可知,原溶液中钾离子的浓度是0.8mol/L×2-0.5mol/L×3=0.1mol/L,答案选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列A~D四组,每组有两个反应,其中两个反应不能用同一个离子方程式表示的是( )
| (Ⅰ) | (Ⅱ) | |
| A | 少量SO2通入Ba(OH)2溶液 | SO2通入过量Ba(OH)2溶液 |
| B | 少量浓氨水滴入Al2(SO4)3溶液 | 少量Al2(SO4)3溶液滴入浓氨水 |
| C | 0.1 mol Cl2通入含0.2 mol FeBr2的溶液中 | 0.3 mol Cl2通入含0.2 mol FeBr2的溶液中 |
| D | 过量BaCl2溶液与少量Na2SO4溶液相混合 | 少量Ba(NO3)2溶液与过量MgSO4溶液相混合 |
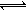 3HF △H >0, H2F2
3HF △H >0, H2F2 