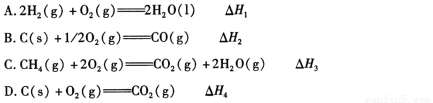题目内容
盖斯定律认为:不管化学过程是一步或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)= H2O(l) △H1 =-Q1 kJ·mol-1(Q1>0)
C2H5OH(g)= C2H5OH(l) △H2 =-Q2 kJ·mol-1(Q2>0)
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3 = -Q3 kJ·mol-1(Q3>0)若使23g液态乙醇完全燃烧,最后恢复到室温,则放出的热量为(kJ)
A.Q1+ Q2+Q3B.0.5(Q1+Q2+Q3 )
C.0.5 Q1-1.5 Q2+0.5Q3 D.1.5 Q1-0.5 Q2+0.5Q3
D
【解析】
试题分析:三个已知方程式为H2O(g)=H2O(l)△H1=-Q1kJ?mol-1 (1)
C2H5OH(g)=C2H5OH(l)△H2=-Q2kJ?mol-1 (2)
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=-Q3kJ?mol-1(3)
乙醇燃烧生成液态水时的化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H
利用盖斯定律求得目标方程式=3(1)-(2)+(3),
即△H=3△H1-△H2+△H3=-(3Q1-Q2+Q3),
23克乙醇的物质的量为23g/46g/mol=0.5mol,
故放出的热量为0.5×(3Q1-Q2+Q3), 故选D.
考点:盖斯定律的利用

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目