题目内容
有下列五个化学方程式(X、Y、Z均为正值):①C2H2(g)+H2(g)![]() C2H4(g)
C2H4(g)
②CH4(g)![]() H2(g)+1/
H2(g)+1/
③C(s)+2H2(g)![]() CH4(g);ΔH=-XkJ·mol-1
CH4(g);ΔH=-XkJ·mol-1
④C(s)+1/2H2(g)![]() 1/
1/
⑤C(s)+H2(g)![]() 1/
1/
当温度下降时①式平衡向右移动,②式平衡向左移动。据此判定③—⑤式中关于X、Y、Z的大小顺序排列正确的是( )
A.X>r>Z B.X>Z>Y C.Y>X>Z D.Z>X>Y
B
【解析】当温度下降时①向右移动,说明正反应是放热反应,ΔH<0;②向左移动,说明该反应是吸热反应,ΔH>0。(⑤-④)×2即为①,ΔH<0,即-Z<-Y,Z>Y;⑤-③即②,ΔH>0,即-Z+X>0,X>Z,所以B正确。

练习册系列答案
相关题目
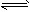 C2H4(g)
C2H4(g) 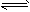 H2(g)+1/2C2H4(g)
H2(g)+1/2C2H4(g) 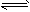 CH4(g);△H= -X kJ·mol-1
CH4(g);△H= -X kJ·mol-1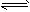 1/2C2H2(g);△H= -Y kJ·mol-1
1/2C2H2(g);△H= -Y kJ·mol-1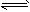 1/2C2H4(g)△H= -ZkJ·mol-1
1/2C2H4(g)△H= -ZkJ·mol-1