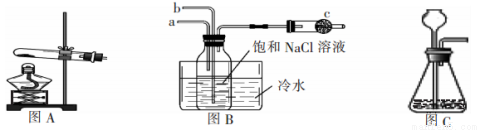
题目内容
工业废水中常含有一定量的 Cr2O72-和 CrO42-,它们会对生态系统产生很大的伤害,工业上对废水处理的工艺流程如下

(1)CrO4中 Cr 的化合价 ;Cr3+的核外电子排布式为 。
(2)写出第①步发生的离子反应方程式 ;若常温下,减小平衡体系的 pH 至 pH=2,则溶液趋向于显 色。
(3)第②步中,还原 0.01mol Cr2O72-离子,需要 mol 的 FeSO4·7H2O
(4)已知 Cr(OH)3 在溶液中存在以下平衡:H++CrO2-+H2O  Cr(OH)3
Cr(OH)3 Cr3++3OH-下列有关说法中正确的是
Cr3++3OH-下列有关说法中正确的是
a.加 HCl 则平衡均向右移动,则生成 Cr3+盐
b.按照物质分类 Cr(OH)3 是两性氢氧化物,属于弱电解质
c.Cr3+盐中逐滴加入 NaOH 溶液,先产生沉淀,后沉淀消失
d.Cr(OH)3 饱和溶液中一定有 c(H )=c(OH )
练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目



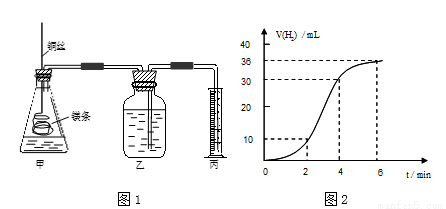

 ,反应速率逐渐减慢,请简述其原_____________________________。
,反应速率逐渐减慢,请简述其原_____________________________。 s)=CaO(s)+CO2(g)则该反应能自发进行的条件是( )
s)=CaO(s)+CO2(g)则该反应能自发进行的条件是( ) 2NH3;②N2+O2
2NH3;②N2+O2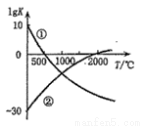
 2SO3(g) ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在条件下开始反应。达到平衡时,下列说法正确的是( )
2SO3(g) ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图所示投料,并在条件下开始反应。达到平衡时,下列说法正确的是( )