题目内容
如表为长式周期表的一部分,其中的序号代表对应的元素.
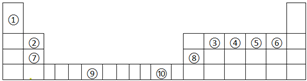
(1)写出上表中元素⑤的轨道表示式 ,元素⑨原子的核外电子排布式 .
(2)元素第一电离能的大小比较:④ ⑤(填写“>”“=”或“<”,下同);元素电负性的大小比较:④ ⑤(填写“>”“=”或“<”);请写出与元素④的单质互为等电子体的一种微粒的化学式 .
(3)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是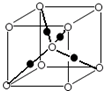 .
.
(4)上述③与④元素组成的(CN)2化合物中σ键与π键之比 .
(5)⑦的氧化物是优良的耐高温材料,它的熔点比CaO高,其原因是 .
(6)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则该氧化物的化学式 .

(1)写出上表中元素⑤的轨道表示式
(2)元素第一电离能的大小比较:④
(3)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是

(4)上述③与④元素组成的(CN)2化合物中σ键与π键之比
(5)⑦的氧化物是优良的耐高温材料,它的熔点比CaO高,其原因是
(6)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则该氧化物的化学式
考点:元素周期律和元素周期表的综合应用,晶胞的计算
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:由元素在周期表中位置,可知①为H、②为Be、③为C、④为N、⑤为O、⑥为F、⑦为Mg、⑧为Al、⑨为Cr、⑩为Cu.
(1)根据核外电子排布规律进行解答;
(2)同周期自左而右第一电离能呈增大趋势,但N元素2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;同周期自左而右电负性增大;
原子总数、价电子总都相等的微粒互为等电子体;
(3)HF分子之间存在氢键,形成缔合(HF)n分子;
(4)化合物(CN)2的结构式为N≡C-C≡N;
(5)氧化镁与氧化钙都属于离子晶体,离子所带电荷相同,离子半径越小,离子键越强,晶格能越大,熔沸点越高;
(6)根据均摊法计算晶胞中各原子数目,确定化学式.
(1)根据核外电子排布规律进行解答;
(2)同周期自左而右第一电离能呈增大趋势,但N元素2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;同周期自左而右电负性增大;
原子总数、价电子总都相等的微粒互为等电子体;
(3)HF分子之间存在氢键,形成缔合(HF)n分子;
(4)化合物(CN)2的结构式为N≡C-C≡N;
(5)氧化镁与氧化钙都属于离子晶体,离子所带电荷相同,离子半径越小,离子键越强,晶格能越大,熔沸点越高;
(6)根据均摊法计算晶胞中各原子数目,确定化学式.
解答:
解:由元素在周期表中位置,可知①为H、②为Be、③为C、④为N、⑤为O、⑥为F、⑦为Mg、⑧为Al、⑨为Cr、⑩为Cu.
(1)⑤为O,原子核外电子排布为1s22s22p4,核外电子轨道排布式为: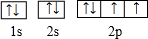 ,
,
⑨为Cr,原子核外电子数为14,根据能量最低原理解洪特规则特例,可知其基态原子核外电子排布为:1s22s22p63s23p63d54s1,
故答案为: ;1s22s22p63s23p63d54s1;
;1s22s22p63s23p63d54s1;
(2)同周期自左而右第一电离能呈增大趋势,但N元素2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O;同周期自左而右电负性增大,故电负性N<O;
元素④的单质为N2,与N2互为等电子体的一种微粒为CO等,
故答案为:>;<;CO;
(3)HF分子之间存在氢键,形成缔合(HF)n分子,故实验测得HF的相对分子质量的值一般高于理论值,
故答案为:HF分子之间存在氢键,形成缔合(HF)n分子;
(4)化合物(CN)2的结构式为N≡C-C≡N,单键为σ键,三键含有1个σ键、2个π键,故(CN)2化合物中σ键与π键之比为3:4,
故答案为:3:4;
(5)氧化镁与氧化钙都属于离子晶体,离子所带电荷相同,Mg2+离子比Ca2+离子半径小,MgO中离子键强,MgO比CaO的晶格能大,故MgO熔沸点高,
故答案为:离子所带电荷相同,Mg2+离子比Ca2+离子半径小,MgO中离子键强,MgO比CaO的晶格能大;
(6)C原子位于晶胞内部,晶胞中含有4个Cu原子,晶胞中O原子数目=1+8×
=2,晶胞中Cu、O原子数目之比=4:2=2:1,故该氧化物化学式为Cu2O,
故答案为:Cu2O.
(1)⑤为O,原子核外电子排布为1s22s22p4,核外电子轨道排布式为:
 ,
,⑨为Cr,原子核外电子数为14,根据能量最低原理解洪特规则特例,可知其基态原子核外电子排布为:1s22s22p63s23p63d54s1,
故答案为:
 ;1s22s22p63s23p63d54s1;
;1s22s22p63s23p63d54s1;(2)同周期自左而右第一电离能呈增大趋势,但N元素2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O;同周期自左而右电负性增大,故电负性N<O;
元素④的单质为N2,与N2互为等电子体的一种微粒为CO等,
故答案为:>;<;CO;
(3)HF分子之间存在氢键,形成缔合(HF)n分子,故实验测得HF的相对分子质量的值一般高于理论值,
故答案为:HF分子之间存在氢键,形成缔合(HF)n分子;
(4)化合物(CN)2的结构式为N≡C-C≡N,单键为σ键,三键含有1个σ键、2个π键,故(CN)2化合物中σ键与π键之比为3:4,
故答案为:3:4;
(5)氧化镁与氧化钙都属于离子晶体,离子所带电荷相同,Mg2+离子比Ca2+离子半径小,MgO中离子键强,MgO比CaO的晶格能大,故MgO熔沸点高,
故答案为:离子所带电荷相同,Mg2+离子比Ca2+离子半径小,MgO中离子键强,MgO比CaO的晶格能大;
(6)C原子位于晶胞内部,晶胞中含有4个Cu原子,晶胞中O原子数目=1+8×
| 1 |
| 8 |
故答案为:Cu2O.
点评:本题是对物质结构的考查,涉及元素周期表、元素周期律、核外电子排布、化学键、晶体类型与性质、晶胞计算等,难度中等,注意理解同周期元素第一电离能突跃原因,掌握物质熔沸点比较.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
选取萃取剂将碘水中的碘萃取出来,下列物质不能作为萃取剂是( )
| A、CCl4 |
| B、酒精 |
| C、直馏汽油 |
| D、苯 |
乙醇分子内脱水的反应属于( )
| A、加聚反应 | B、取代反应 |
| C、加成反应 | D、消去反应 |
设NA为阿佛加德罗常数的数值,下列说法正确的是( )
| A、1L 1mol?L-1的Na2CO3 溶液中含有CO32-的数目为NA |
| B、25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| C、一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数一定为0.1NA |
| D、1mol Fe与足量的稀HNO3反应,转移2NA个电子 |
化学源于生活,同时又服务于生活,下列说法不合理的是( )
| A、田间焚烧秸秆污染环境,浪费资源 |
| B、泄露在海洋中的大量原油能被海洋生物迅速分解,不会导致生态灾难,不需要治理 |
| C、推广使用无磷洗涤剂,可有效减少水体的富营养化 |
| D、服用铬含量超标的药用胶囊会对从体健康造成危害 |
